SOLUBILITY OF Fe(III)-GLYCINE-NTA COMPLEXES IN AQUATIC SYSTEMS
Vlado Cuculic* and Marko Branica
Center for marine and environmental research, Rudjer Boškovic Institute, Bijenicka 54, 10001 Zagreb, Croatia
*cuculic@rudjer.irb.hr, branica@rudjer.irb.hr
Abstract
Solubility of iron(III)-glycine-NTA mixed complex in aquatic solution was measured by cathodic voltammetry with static mercury drop
electrode. Experimental determined Fe(III) retention time in soluble phase at pH = 8.1 in 0.1 mol L
-1
NaClO
4
was found to be more than
18 hours. It was achieved by addition of NTA to the iron(III)-glycine water solution. Under these conditions, iron(III) hydrolysis was
sufficiently suppressed.
Keywords: aquatic system, iron(III), mixed complex, glycine, nitrilotriacetate, voltammetry.
Rapp. Comm. int. Mer Médit., 37,2004
185
Introduction
Iron is one of the most abundant metal on the earth’s crust with a
great biogeochemical importance in natural aquatic systems. It is an
essential element whose key chemical and biological functions
involve oxidation/reduction processes and interactions with oxygen
(1). However, its strong tendency toward hydrolysis and precipitation
is limiting factor for iron occurrence in soluble phase in natural
aquatic systems (2). Soluble form of Fe(III) is necessary for
phytoplankton growth. Iron is thought to be an element that regulates
ecosystem structure and rate of primary production in large areas of
the ocean (3). Dissolved iron concentrations in the surface waters of
the Pacific area are < 0.1 nM, so rate of input of bioavailable iron must
exert a strong in?uence on ocean productivity in these systems (3,4).
The major source of iron in the ocean is deposition of atmospheric
dust particles. However, iron oxyhydroxide particles and iron colloids
are not directly available to phytoplankton due to their insolubility (4).
Ionic iron must be in soluble form during sufficient period of time in
order to be available to the phytoplankton. It is mainly achieved by
organic complexation of iron(III) (1).
Methods and materials
µAUTOLAB analyzer (ECO Chemie, Utrecht, NL) and an
electroanalytical quartz cell (20 ml) were used in experiments. The
working electrode was a standing mercury drop electrode (SMDE),
Ag/AgCl as reference electrode and counter electrode was platinum
wire. The stock solutions of 10
-2
mol L
-1
of Fe(NO
3
)
3
x9H
2
0 (p.a.,
Kemika, Croatia), 10
-2
mol L
-1
of disodium nitrilotriacetate
(Na
2
NTA) (Sigma-Aldrich Chemie, Germany), 1 mol L
-1
of glycine
and 7.13mol L
-1
of the NaClO
4
(p.a., Fluka Chemie, Switzerland)
with bidistilled, Milli-Q water were prepared.
Results and discussion
The electrochemical measurements were performed in a 0.1 mol
L
-1
NaClO
4
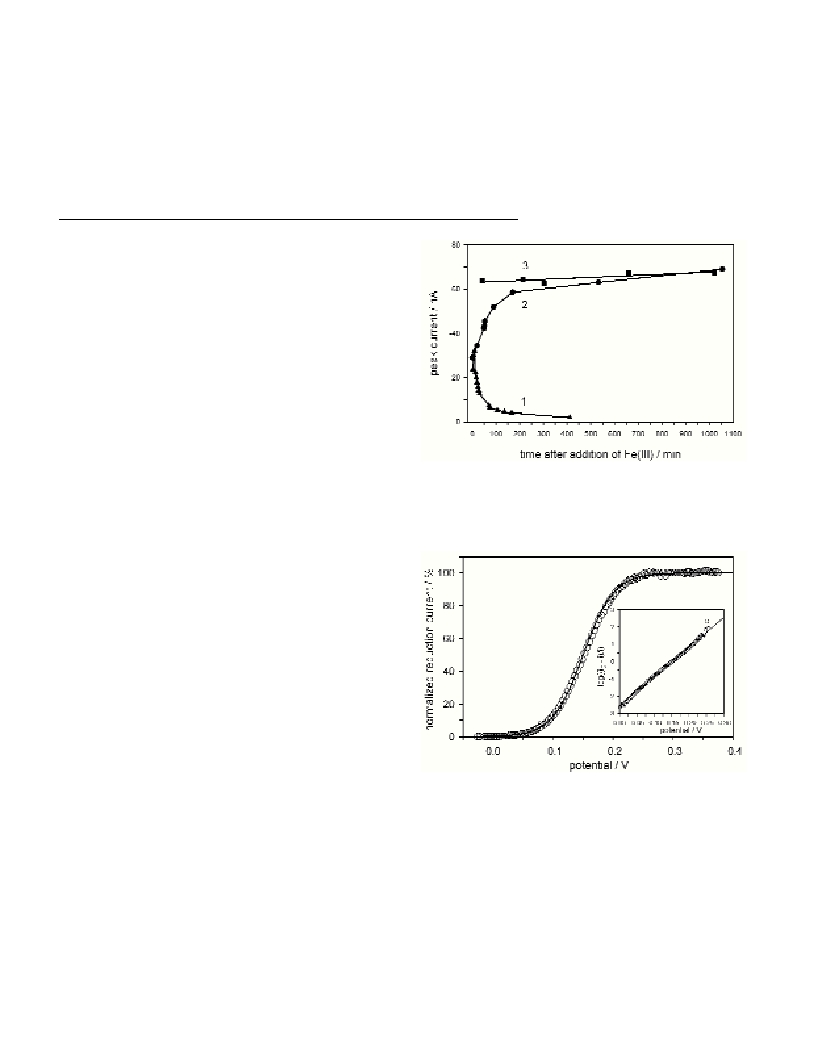
water solution at pH = 8.1. Figure 1 shows differential
pulse Fe(III) reduction peak current dependence on the time of the
experiment. In figure 1, curve 1 shows reduction currents of the
Fe(III) - glycine complex without NTA added. Advanced hydrolysis
after only few minutes since Fe(III) addition is observed. This
complex is very unstable5 at pH = 8.1 (natural seawater pH) and
hydrolysis prevails over formation of Fe(III)-glycine complex. In
figure 1, curve 2 shows Fe(III) reduction where NTA was added about
50 minutes after preequilibration of iron(III) and glycine. Before the
addition of NTA, Fe(III)-glycine complex was formed, which has very
strong tendency toward hydrolysis
(5)
. After NTA addition, gradually
formation of mixed Fe(III)-glycine-NTA complex takes place. After
about 8 hours, mixed complex peak current achieves constant values.
It is clear that presence of the both ligands, glycine and NTA,
stabilizes iron(III) in soluble phase because peak current (Fig. 1, curve
2) was constant over 18 hours. When NTA was added into glycine
water solution prior to addition of iron(III) ions, Fe(III) mixed
complex was formed instantaneously (Fig. 1, curve 3). So, addition of
NTA in Fe(III)-glycine water solution results in formation of the
highly stabilized Fe(III)-glycine-NTA mixed complex that keeps
iron(III) in soluble phase more than 18 hours.
Figure 2 shows d.c. polarogram of the Fe(III)-glycine-NTA
reduction and logarithmic dependence of the reduction currents on
potential (insert). Logarithmic analysis of the polarogram gives us a
slope value 58.8±0.04 mV. Number of electrons in reaction depends
on slope as follows: slope = 0.059V / n, for reversible electrode
reaction. That clearly shows that oxidation/reduction reaction of the
Fe(III)-glycine-NTA mixed complex is one-electron, reversible
electrode reaction.
Fig. 1. DP reduction peak current dependence on the time of the
experiment. 1: Fe(III)-glycine reduction; 2: Fe(III)-glycine-NTA reduction,
NTA added after 50 min.; 3: Fe(III)-glycine-NTA reduction; c(Fe
3+
) =
2.5x10
-5
mol L
-1
; 0.2 mol L
-1
glycine; 5x10
-4
mol L
-1
NTA; 0.1 mol L
-1
NaClO
4
; pH = 8.1; DE= 2 mV; a= 25 mV; t
pulse
= 0.05 s;
?
t
pulse
= 0.2 s.
Fig. 2. D.C. polarogram of the Fe(III)-glycine-NTA reduction and
logarithmic dependence of the reduction current on potential (insert).
c(Fe
3+
) = 2x10
-4
mol L
-1
; 0.02 mol L
-1
glycine; 5x10
-4
mol L
-1
NTA;
0.1 mol L
-1
NaClO
4
; pH = 8.1; drop time = 0.5 s;
?
E= 2 mV.
References
1-Sunda, W.G., Huntsman, S.A., 1995. Iron uptake and growth limitation
in oceanic and coastal phytoplankton.Mar. Chem., 50: 189-206.
2-Crumbliss, A.L., Garrison, J.M., 1988. A comparison of some aspects
of the aqueous coordination chemistry of aluminum(III) and iron(III).
Comments Inorg. Chem., 8: 1-26.
3-Martin, J.H., Fitzwater, S.E., 1988. Iron deficiency limits
phytoplankton growth in the north-east Pacific subarctic.Nature, 331:
341-343.
4-Liu, X., Millero, F.J., 2002. The solubility of iron in seawater.Mar.
Chem., 77: 43-54.
5-Cuculic, V., ,2003. Electrochemical reactions of iron ions and
complexes in water solutions. Doctoral Thesis, University of Zagreb.