Rapp. Comm. int. Mer Médit., 37,2004
228
PHYTOPLANKTON INFLUENCE ON THE CHROMIUM SPECIATION IN SEAWATER
M. Mlakar
1*
, Y. Auger
2
, M. Branica
1
1
Laboratory of Physical Chemistry of Traces, Rudjer Boskovic Institute, Bijenicka 54, 10000 Zagreb, Croatia
2 Laboratory for Analytical and Marine Chemistry, University of Sciences and Technology of Lille, UPRES A CNRS 8013,
59655 Villeneuve d’Ascq, France
Abstract
Processes controlling dissolved chromium species distribution in seawater were studied. Various organic matter distributions, in-situ
reduction and absorption/desorption by algae cells, particulate organic matter, contribute to the spatial speciation of dissolved chromium.
Keywords: chromium speciation, organic matter, phytoplankton.
Introduction
In seawater chromium exists as Cr(VI) and Cr(III) [1-3]. Cr(VI) is
present as CrO
42-
which adsorbs on proton-specific mineral surfaces,
limited in the presence of competing anions such as sulfate [4]. It has
high bioavailability regarding aquatic organisms. Cr(III) forms strong,
kinetically inert complexes [5] and it is very stable in a hydrolyzed
form [6,7]. Its toxicity and bioavailability, controlled by a solubility
and formation of strong complexes with organic and hydroxo-
complexes, is low. Oxidation states are in?uenced by: oxic and anoxic
conditions [1], photochemical [8]/geochemical processes [9], and
biological activities (phytoplankton bloom) [10].
Materials and methods
Sampling was done in the region of Irish sea and Celtic Sea,
including surface, subsurface - 5 m and bottom waters - 5 m above.
Voltammograms were recorded with Autolab polarograph (Eco-
chemie, Netherlands). The system was supported by the GPES4.3
electroanalytical program. Metrohm model 663 hanging mercury drop
electrode (HMDE) was used as a working (0.4 mm
2
), Ag/AgCl as a
reference and glassy carbon as a counter electrode, and te?on cell.
Axenic and specific strain of phytoplanktonRhodella violacea
culture was grown in thermostated ?asks (16°C) and illuminated by
the 150
µ
E/m
2
s light in artificial seawater.
Results and discussion
Main goal of this study was to investigate Cr(VI)/(III) distribution
in correlation with organic matter in seawater [2,8-10]. Samples were
taken in the region of Celtic and Irish Sea, with different
characteristics concerning temperature, stratification and homogenity
of water column, respectively. In the Celtic Sea thermocline is formed
between 20 and 40 m, while Irish Sea is homogeneous. Celtic Sea
samples were taken at the surface, over and under the thermocline (20
and 45 m), and on the bottom (120 m). Dissolved Cr(VI)
concentration is constant down to 20 m, in the region of thermocline
increases until 40 m and remains unchanged until the bottom. The
behavior of dissolved Cr(III) is opposite. These results were
correlated with the appearance of the particulate organic matter. In the
Celtic Sea concentration of particulate organic carbon (POC) is much
higher on the surface than on the bottom. POC decrease was
pronounced in the region below the thermocline. POC fractions
indicate: surface waters contain an important algal but lesser content
of bacterial fraction, separated by the thermocline. In the non-
stratified water column of Irish Sea POC change with depth
uniformly. Bacterial contribution is pronounced on the bottom,
suggesting mineralization processes of the phytoplankton organic
matter. Taking into account the POC origin and abundance, dissolved
chromium distribution could be described: phytoplankton cells absorb
Cr(VI) in the form of the chromate anion due to its resemblance to the
nutrient sulfate anion. In cells reduces and after destruction is released
into the sea as Cr(III). Among other processes, Cr(III) adsorbs on the
phytoplankton detritus and in that way is partially eliminated from the
seawater column. In the homogeneous water column same process is
more pronounced in a zone of the nutrient regeneration, near
sediments.
In order to verify these presumptions experiments in the laboratory
with a phytoplankton batch culture of Rhodella violacea (chosen as
one of most stable algae cultures in laboratory conditions), were done.
The algae growth occurs in three phases:
1. until 9
th
day: the culture grows slowly and number of cells
duplicate in chosen periods;
2. significant growth, from 9
th
to 23
rd
day, the phytoplankton bloom;
3. cell number decreases rapidly, different from the stationary phase
normally achieved in the traditional medium for the culture
development.
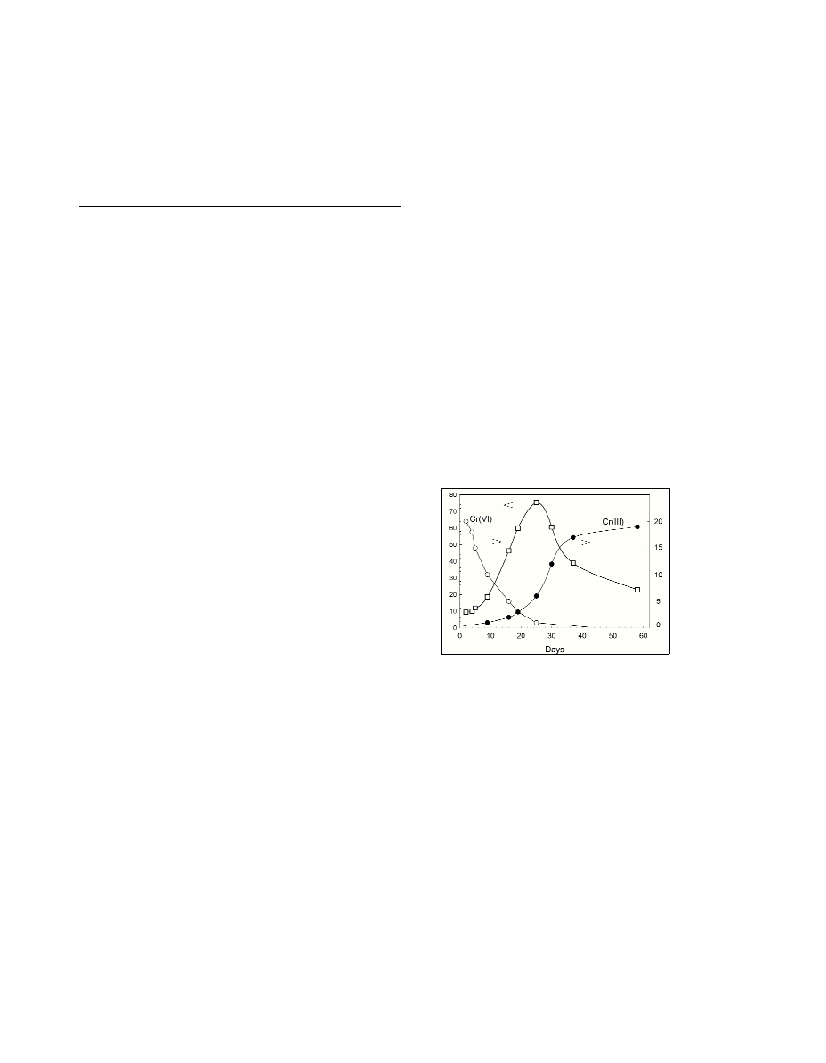
In each sample of the phytoplankton culture 20 nM of Cr(VI) was
added. Dissolved Cr(VI) concentration diminished from 4
th
to 23
rd
day, assuming uptake by phytoplankton (Fig. 1). Cr(III) concentration
increased with cell number decrease. It was presumed that Cr(VI) is
reduced in the cells to Cr(III) and released as cells were destructed.
However, phytoplankton cannot completely drive the fate of
chromium in dissolved phase. Positive correlations between
particulate chromium and organic carbon from bacterial and
uncharacterized origins appear, what suggests an “association”
between chromium and organic particles built-up from senescent or
degraded phytoplanktonic cells. Examination of organic carbon
fractions showed more precisely that this correlation was almost
exclusively due to the fresh algal component representing the larger
part of the POC. It suggests that chromium behaviour could be
in?uenced by phytoplanktonic activity. This activity produces organic
exudates which are well known as chelating agents [11], i.e.
phytoplanktonic exudates. Algal cells that were in a good
physiological condition could remove chromium (VI) from seawater
column (negative correlation), and after its incorporation/
transformation, could release chromium (III) (positive correlation).
Fig. 1. Dissolved
[Cr(VI)] and [Cr(III)]
in dependence of
time of contact with
the batch culture of
Rhodella violacea.
References
1-Ahern, F, Eckert, J.M., Payne, C. & Williams, K.L., 1985. Speciation of
Chromium in Seawater,Anal. Chim. Acta, 175: 147-151. And lit. cited therein.
2-Jeandel, C., 1987. Cycles biogéochimiques océaniques du chrome et
du vanadium. Ph.D. Thesis, University of Paris, 264 p.
3-Boussemart, M.,van den Berg, C.M.G. & Gaddaf, M. (1992). The
determination of the chromium species in seawater using catalytic
cathodic stripping voltammetry. Anal. Chim. Acta, 262
:
103-115.
4-Zachara, J.M., Girvin, D.C., Schmidt, R.L. & Resch, C.T., 1987.
Chromate adsorption on amorphous iron hydroxyde in the presence of
major groundwater ions. Environ. Sci. Technol., 21: 589-594.
5-Pearson, R.G., 1966. Acids and Bases, Science, 151: 172-177.
6-Rai, D., Sass, B.M. & Moore, D.A., 1987. Chromium hydrolysis
constants and solubility of chromium hydroxide. Inorg. Chem., 26: 345-349.
7-Murray, J.W, Spell, B. & Paul, B., 1983. The contrasting geochemistry
of manganese and chromium in eastern Pacific Ocean.Pp. 643-669.In:
C.S. Wong et al.(ed.), Trace Metals in Seawater, Plenum Press.
8-Kleber, R.J. & George, R.H., 1992. Indirect Photoreduction of
Aqueous Chromium(VI).Environm. Sci. Technol., 26: 307-312.
9-Abu-Saba, K.E. & Flegal, A.R., 1995. Chromium in San Francisco
Bay: superposition of geochemical processes causes complex spatial
distribution of redox species. Mar. Chem., 49: 189-199.
10-Eckert, J.M., Stewart, J.J., Waite, T.D., Szymezek, R. & Williams,
K.L., 1990. Reduction of chromium (VI) at sub-
µ
g/l levels by fulvic acids.
Anal. Chim. Acta, 236:357-362.
11-Sunda, W.G. and Huntsman, S.A., 1995. Iron uptake and growth
limitation in oceanic and coastal phytoplankton. Marine Chemistry50:
189
¯
206.