Rapp. Comm. int. Mer Médit., 37,2004
276
HOW MUCH DO BACTERIA DEPEND ON PHYTOPLANKTON METABOLISM?
González-Benítez N.
1*
, Gattuso J.P.
2
1
Área de Biodiversidad y Conservación. ESCET. Universidad Rey Juan Carlos. E-28933 Madrid, Spain
2
LOV - UMR 7093. BP 28. F-06234 Villefranche-sur-Mer, France
Abstract
The degree of coupling between phytoplankton and bacteria was estimated in the Bay of Palma during summer 2002 by comparing the
relative proportions of particulate and dissolved primary production with bacterial carbon demand. On the whole, these results suggest,
that the bacterial growth efficiency responds to changes in phytoplankton production, increasing as the primary production increases. In
summary, there is lack of dependence of bacterial metabolism on algal production in the oligotrophic area, whereas the most productive
area showed a strong coupling between phytoplankton and bacterioplankton.
Keywords: Bacterial metabolism, PER, oligotrophy, BGE
Introduction
The production of dissolved organic carbon (DOC) is important in
oceanic biogeochemistry and there are many different mechanisms of
production although the ultimate source is phytoplankton. Dissolved
primary production (DOC-pr) in marine systems has been often
ignored because it is considered to be very low compared with the
particulate fraction (POC-pr). Some authors (1) have suggested that
the rate of POC-pr and the relative contribution of DOC-pr to total
carbon fixation (PER) are inversely correlated, although other
authors(2) have reported that PER is constant across marine and
freshwater systems. Thus the issue, still unresolved, is important,
since dissolved organic carbon represents an important source of
labile carbon for heterotrophic bacteria(3). Depending on the bacteria
growth efficiency (BGE), DOC consumed by bacteria will be either
converted to POC or respired as CO
2
decreasing the organic carbon
transfer to higher trophic levels. Both processes of bacterial
metabolism, production and respiration, against the general idea are
not well coupled, providing a metabolic ?exibility necessary for
survival under oligotrophic conditions(4). According to a recent
study(5) the carbon cycle is mainly determined by the combined
activities of bacteria and phytoplankton. Therefore, variations in BGE
will affect the degree of coupling between bacteria and phytoplankton
and, consequently, the biogeochemical cycles within marine
ecosystems. Given the lack of simultaneous measurements of the
BGE and the balance between DOC-pr and POC-pr, particularly in
oligotrophic regions (although they cover ca 70% of the total marine
surface), we have carried out the present experiment.
Material and methods
The study was conducted at Bay of Palm during June 2002. The
water samples were collected at four depths between surface and 15
or 30 m depth. For phytoplanktonic POC-pr and DOC-pr rates, the
seawater samples were dispensed into 30 ml glass bottles (three clear
and one dark), spiked with 740 Kbq (20
µ
Ci) NaH
14
CO
3
and
incubated in situduring the daylight period (12 h). Bacterial
production (BP) was estimated as the rate of radioactive Leucine
incorporation(6). For bacterial respiration (BR), the seawater samples
were filtered, using a gentle filtration system (0.8 µm). The filtered
water was incubated in 60 ml borosilicate glass bottles at in situ
temperature (
±
1 şC) in the dark over 12, 24 and 48 h.
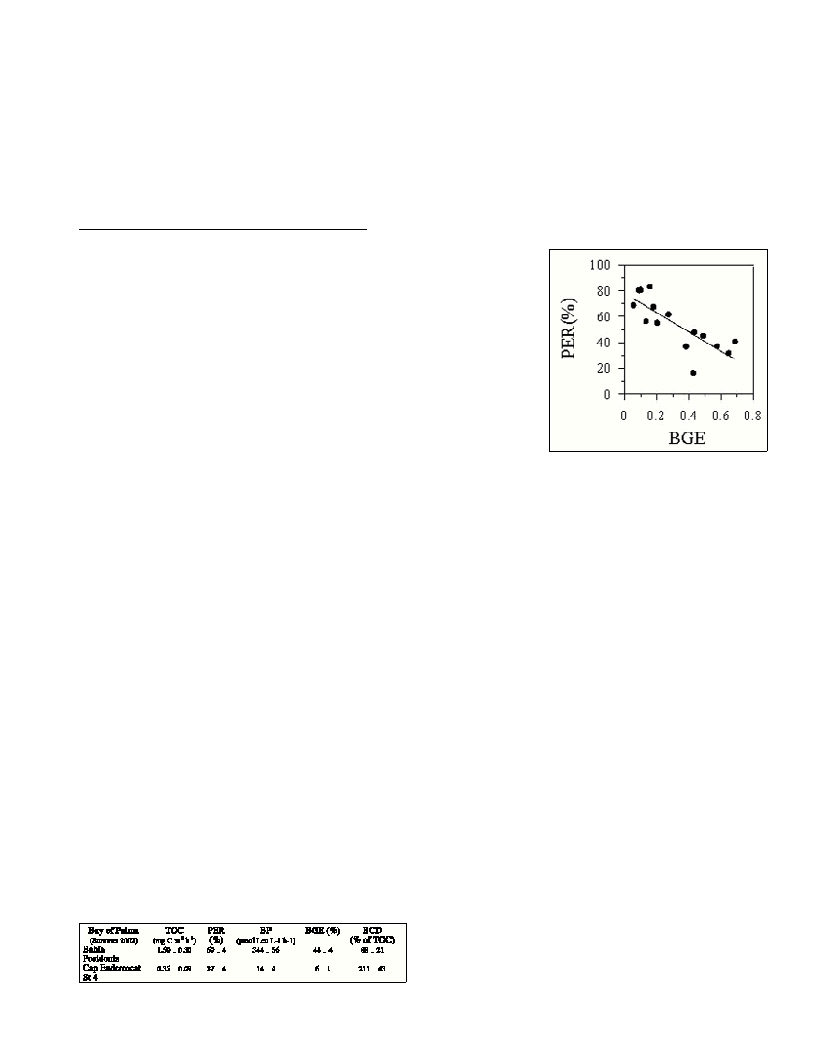
Results
We observed two contrasting regions within an oligotrophic aquatic
system (Table 1). The percent of extracellular release (PER) was
significantly lower within the most productive areas. However,
bacterial production (BP) and BGE were higher in the most
productive areas. BGE increased as the relative contribution of DOC-
pr to total carbon fixation decreased (Fig. 1).
Table 1.-Mean (±SE) values of total carbon fixation (TOC-pr), percent of
extracellular release (PER), bacterial production (BP), bacterial growth
efficiency (BGE) and bacterial carbon demand (BCD) during summer
2002 in the Bay of Palma.
Conclusions
The relative con-
tribution of DOC-pr
to total primary
production decrea-
ses as the produc-
tivity of the system
increases. In agree-
ment with a recent
study(7), this result
provides evidence
that PER is not
constant, even wi-
thin oligotrophic
waters.
There was an im-
portant bacterial
response to the variability in primary production by adapting their
metabolism to this oligotrophic environment. BGE responded to
changes in phytoplankton production, increasing as the primary
production increased.
The organic carbon was consumed by bacteria less efficiently
within the most oligotrophic area and most of the carbon was respired.
Whereas the area with higher primary production, the energetic cost
of bacterial growth appeared to decrease and therefore BGE
increased.
There was a clear evidence of the small scale spatial variability
within this oligotrophic aquatic system showing lack of dependence
of bacterial metabolism on algal production within the less productive
area, and strong coupling between phytoplankton and
bacterioplankton within the most productive area.
References
1-Fogg G.E., 1983. The ecological significance of extracellular products
of phytoplankton photosynthesis. Bot Mar.,26: 3-14.
2-Baines S.B., Pace M.L., 1991. The production of dissolved organic
matter by phytoplankton and its importance to bacteria: patterns across
marine and freshwater systems. Limnol Oceanogr.,36:1078-1090.
3-Kirchman D.L., Suzuki Y., Garside C., Ducklow H.W., 1991. High
turnover rates of dissolved organic carbon during a spring phytoplankton
bloom. Nature, 352: 612-614.
4-del Giorgio P.A., Cole J.J., 1998. Bacterial growth efficiency in natural
aquatic systems. Annu. Rev. Ecol. Syst.,29: 503-541.
5-Azam F., 1998. Science, 280:694-696.
6-Smith D.C., Azam F., 1992. A simple economical method for
measuring bacterial protein synthesis rates in seawater using
3
H-Leucine.
Mar. Microb. Food Webs,6: 107-114.
7-Moran X.A.G., Estrada M., Gasol J.M., Pedrós-Alió C., 2002.
Dissolved primary production and strength of phytoplank-
ton–bacterioplankton coupling in contrasting marine regions. Microb
Ecol.,44: 217-223.