Rapp. Comm. int. Mer Médit., 37,2004
278
RECOVERY OF VIABLE BUT NONCULTURABLE AEROMONAS HYDROPHILACELLS AND
MAINTENANCE OF ABILITY TO ADHERE TO MCCOY CELLS AFTER RESUSCITATION
S. Maalej
1*
, R. Gdoura
2
and A. Bouain
1
1
Faculté des Sciences de Sfax, Unité de rechercheUR/0907. 3018, Sfax, Tunisia - * sami.maalej@fss.rnu.tn
2
Faculté de Médecine de Sfax, Laboratoire de Microbiologie. Sfax, Tunisia
Abstract
Maintenance of pathogenicity of viable but nonculturable Aeromonas hydrophilacells experimentaly stressed at 5°C in natural seawater
microcosms was investigated. Pathogenicity, in terms of cytotoxicity and ability to adhere to McCoy cells, was lost concomitantly with
culturability, whereas cell viability remained undamaged, as determined by the direct viable count. Recovered cells, by a temperature shift
from 5 to 23°C restore their adhesion properties.
Keywords: Aeromonas hydrophila, VBNC, resuscitation, pathogenicity
Aeromonas hydrophila is an opportunist human pathogen which is
widely distributed in aquatic environments (1,2). A relationship
between changes in water temperature and the incidence of
Aeromonasspp. has been reported. In seawater within arid regions,
aeromonads were found in high numbers in late summer/early autumn
when the temperature was around 20-25°C and were rarely detected
during cold seasons (3). The inability to isolate A. hydrophiladuring
the winter months or from cold waters may result from the entry of
cells into the viable but nonculturable (VBNC) state (4). However,
contreversial results were produced from attempts to restore
culturability. Moreover, in our knowledge, none of the reported
studies adressing the pathogenicity of A. hydrophilanonculturable
and recovered cells.
In this study, A. hydrophilaATCC 7966 with cytotoxic activity was
used for entering the VBNC state when it was incubated in filtered
sterilized natural seawater. Cells were grown on BHI broth, collected
and immediately suspended in 0.5-liter bottles containing 100 ml of
filter-sterilized natural seawater to obtain a final concentration of 10
8
cfu.ml
-1
and incubated without shaking at 5°C. At fixed times,
samples were collected for culturable, total and Direct Viable
Counting (5). After about 45 days of starvation, when the culturable
cells declined below the detection level of 0.1 cfu.ml
-1
, microcosms
were shifted to room temperature (23°C) without exogenous nutrient
addition. Culturable cells first appeared after one day then increasing
to a maximum of 10
4
cfu. ml
-1
within 3 days of room temperature
incubation. Comparison of the growth rates of the stressed population
and of the untreated bacteria growing in the same autoclaved initial
cell suspension, significantly showed faster growth for the stressed
cells, suggesting that in addition to growth of the few culturable
stressed cells, a given amount of injured cells entered a culturable
state.
In order to test the pathogenicity of culturabe, VBNC, and
recovered cells, attachment ability and cytoxic activity with McCoy
cells were used. Each bacterial suspension was adjusted to 10
6
viable
(i.e. DVC-positive) bacteria and a portion of 300 ?l of a bacterial
suspension was added to the cell monolayer. After 1 h of incubation at
37°C in a 5% CO
2
atmosphere to permit bacterial adhesion, the cells
were stained with Giemsa for 1 mn and visualized by light
microscopy under oil immersion at a magnification of x 100. Our
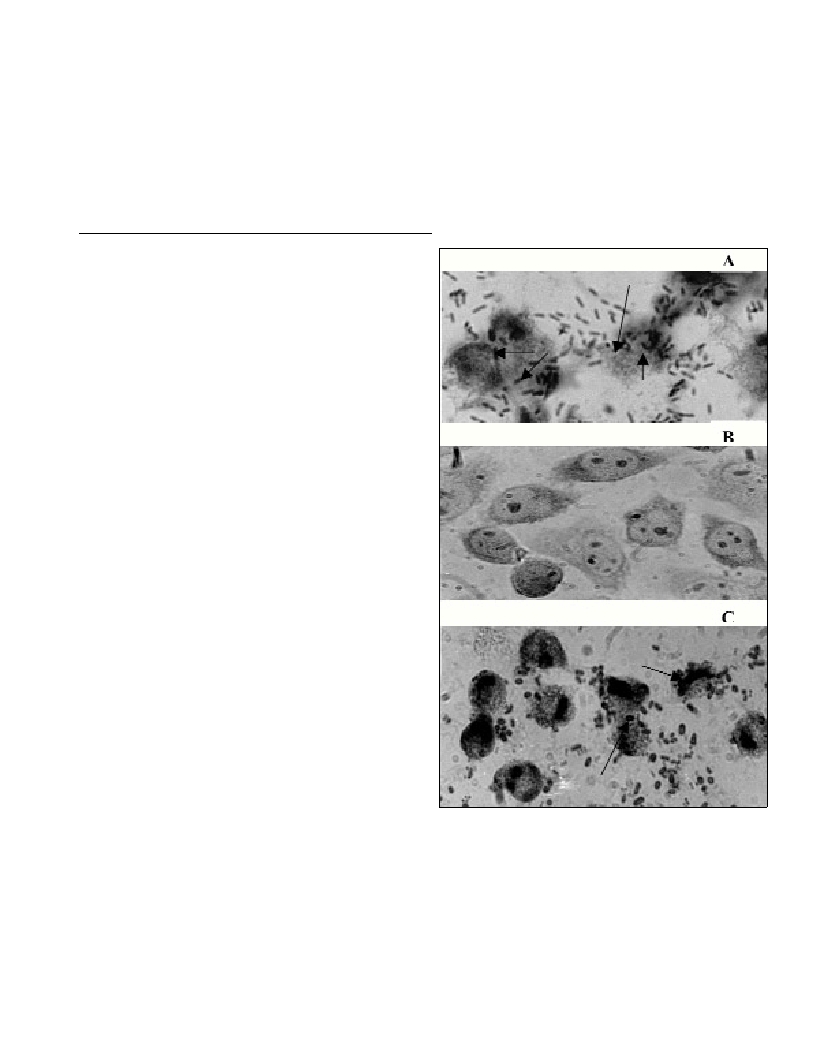
results showed clearly that entry into the VBNC state was
accompanied by a loss of the adhesion property (Fig. 1A and B). This
loss is transient because, after temperature upshift, the ability to
adhere to McCoy cells was recovered. (Fig. 1C).
References
1-Janda, J. M. & Abott, S. L. 1998. Evolving concepts regarding the
genus Aeromonas: an expanding panorama of species, disease
presentation, and unanswered questions. Clin. Infect. Dis.,27: 332-344.
2-Schiavano, G., Bruscolini, F., Albano, A. & Brandi, G. 1998. Virulence
factors in Aeromonas spp. and their association with gastrointestinal
disease. New Microbio.,21: 23-28.
3-Maalej, S., Mahjoubi, A., Elazri, C. & Dukan, S. 2003. Simulaneous
effects of environmental factors on motile Aeromonasdynamics in an
urban effluent and in the natural seawater. Water Res.,37: 2865-2874.
4-Wai, S. N., Mizunoe, Y., Takade, A. & Yoshida, S. 2000. A comparison
of solid and liquid media for resuscitation of starvation-and low-
temperature-induced nonculturable cells of Aeromonas hydrophila. Arch.
Microbiol.,173: 307-310.
5-Kogure, K., U. Simidu, and N. Taga. 1979. A tentative direct
microscopic method for counting living marine bacteria. Can. J.
Microbiol., 25: 420.
Fig. 1. Photograph of Aeromonas hydrophila cells in the adhesion assay
with McCoy cells. (A) Adhesion by culturable cells, representing the day
0 sample. (B) Adhesion by VBNC cells collected after 45 days. (C)
Adhesion by recovered cells after 3 days.