Rapp. Comm. int. Mer Médit., 37,2004
284
ACTIVATION OF CARBONIC ANHYDRASE IN BRANCHIAL CAVITY TISSUES
OF LOBSTER HOMARUS GAMMARUS CONDITIONED BY DILUTE SEAWATER
Dijana Pavicic-Hamer* and Cedomil Lucu
Institute Rudjer Boškovic, Center for Marine Research, G. Paliage 5, 52210 Rovinj, Croatia
* pavicic@cim.irb.hr
Abstract
The activity of carbonic anhydrase (CA) and its distribution in the branchial cavity tissues has been studied in the lobster Homarus
gammarusfrom ambient seawater (SW, salinity 38) and dilute seawater (DSW, salinity 20). In DSW-acclimated lobsters, almost 70% of
total CA in tissues of the branchial cavity was found in epipodites and the rest was equally distributed between branchiostegites and gills.
In cytosol fractions of tissues from DSW acclimated lobsters, the main proportion of 76% in epipodites, 61% in branchiostegite of total
CA activity. Partially purified membranes contained 7% in epipodites and 16% in branchiostegite. These results indicate the importance
of epipodites and branchiostegite in CA induction when lobsters are acclimated to DSW.
Keywords: carbonic anhydrase; dilute seawater; branchial cavity tissues; lobster Homarus gammarus
Introduction
Lobsters Homarus gammarusare mainly described as a non-
regulating stenohaline species, able to tolerate only a narrow range of
seawater salinity (1). However, recently it was found that lobsters can
also temporary migrate to estuarine habitats where salinity ?uctuates
(2). In the lobsters acclimated to DSW, the specific activity of
Na
+
,K
+
-ATPase was increased, particularly in the epipodites and the
gills (3, 4). In addition to Na
+
,K
+
-ATPase, CA represents a key
enzyme involved in the ion osmoregulation in hyperosmoregulating
crabs, where it supplies ions for maintaining osmoconcentration
gradients between the haemolymph and ambient seawater (5). CA is
a multifunctional enzyme, with an additional role in respiration and
acid-base regulation in the cells. CA supplies cells with H
+
and
HCO
3-
, which then serve as counterions for the active uptake of
important osmolytes Na
+
and Cl
-
(6). In this work we studied CA of
branchial cavity tissues during acclimation to DSW of the
osmoregulating commercially important lobster Homarus gammarus.
Materials and methods
European lobsters Homarus gammarus(Linnaeus, 1758), weighing
312
±
110 g, were collected on the west Istrian coast of Adriatic Sea
near Rovinj, Croatia. The activity of CA was measured using a
modified method by comparison of uncatalyzed and catalyzed
reaction times in tissue homogenates (with addition of Triton-100)
(7). Differential centrifugation of tissues homogenates was used for
measurements of the CA distribution in subcellular fractions, and to
define the relation and distribution of cytosolic and membrane-bound
CA (8).
Results and discussion
In lobsters acclimated to DSW, the adjustment of the blood
hyperosmolarity is correlated with increased activity of Na
+
,K
+
-
ATPase in epipodites and branchiostegite (3, 4). In the lobsters
acclimated to DSW for two weeks, CA activity in the branchiostegite
and epipodite was 8 and 6 times higher than the CA activity in lobsters
held in SW (Fig. 1). These results show that epipodite and
branchiostegite have an important osmoregulatory role when lobsters
are acclimated to DSW.
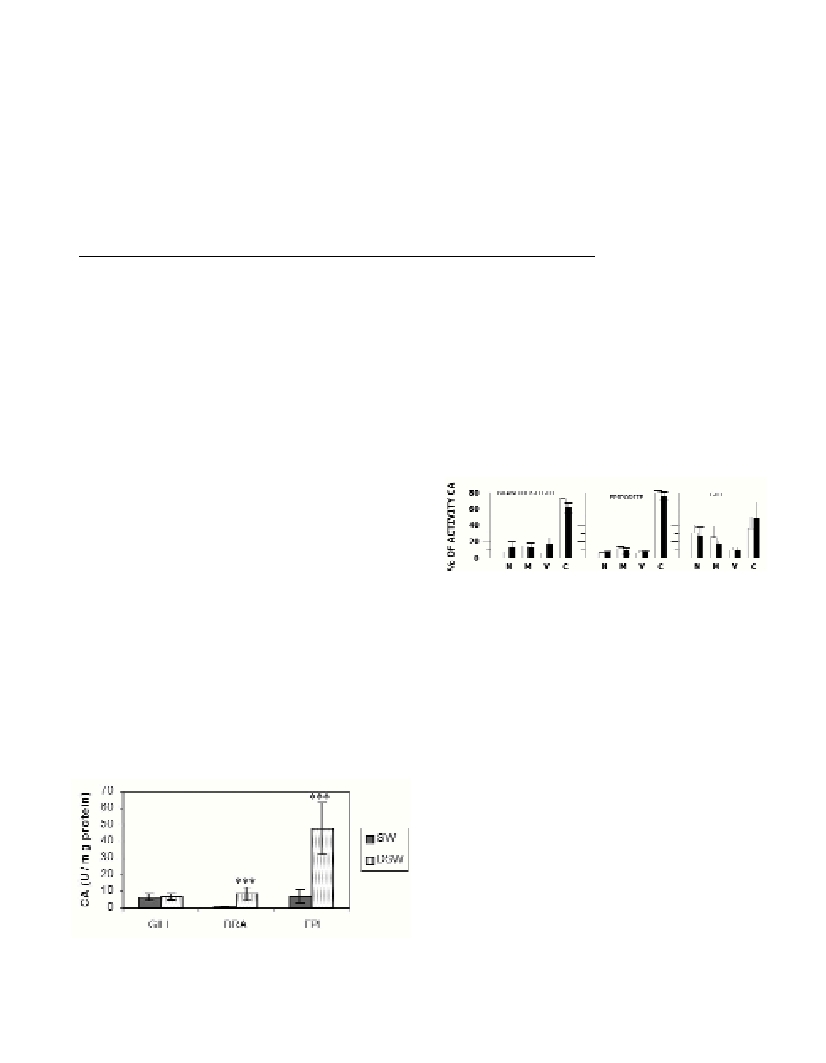
Differential centrifugation of tissues showed that the cytosolic
fraction of CA was inducible by exposure of lobsters to lower SW
osmoconcentration (Fig. 2). In epipodites and branchiostegite the
cytosolic fraction of CA in DSW acclimated lobsters amounted to
76% and 61%, respectively, of the total CA activity. The respective
proportion of CA bound to membrane fraction from epipodites and
branchiostegite of DSW-acclimated lobsters amounted to 7% and
16% of the total CA (Fig. 2). A slight activation of CA in
homogenates and in partially purified membranes of gills was not
confirmed as a statistically significant difference between the SW and
DSW groups. Our results on the dominant proportion of the cytosolic
CA are in accordance with results of Henry (5). We suggest that CA
is mainly involved in the transport of osmolyte ions and respiration.
The adaptive ion regulating mechanism in lobsters maintain
homeostasis when lobsters migrate to brackish water habitats with a
?uctuating salinity. Moreover, results provide knowledge to protect
lobster populations in marine habitats.
Fig. 2. Distribution of CA activity in subcellular fraction (N = nuclear; M
= mitochondrial; V = membrane and C = cytosol) of epipodite,
branchiostegite and gills from lobsters acclimated to SW (open bars) and
DSW (dark bars).
References
1-Péqueux A., 1995. Osmotic regulation in crustaceans. J. Crustacean
Biol., 15(1): 1-60.
2-Linnane A., Ball B., Munday B., and Mercer J.P., 2000. On the
occurrence of juvenile lobster Homarus gammarusin intertidal habitat. J.
Mar. Biol. Ass. U K, 80: 375-376.
3-Lucu C., and Devescovi M.,1999. Osmoregulation and branchial
Na
+
,K
+
-ATPase in the lobster Homarus gammarus acclimated to dilute
seawater. J. Exp. Mar. Biol. Ecol., 234: 291-304.
4-Flik G., and Haond C., 2000. Na
+
and Ca
+
pumps in the gills,
epipodites and branchiostegites of the European lobster Homarus
gammarus: effects of dilute sea water. J. Exp. Biol., 203: 213-220.
5-Henry R.P., 2001. Environmentally mediated carbonic anhydrase
induction in the gills of euryhaline crustaceans. J. Exp. Biol., 204: 991-
1002.
6-Henry R.P., 1996. Multiple roles of carbonic anhydrase in cellular
transport and metabolism. Annu. Rev. Physiol., 58: 523-538.
7-Bruns W., Dermietzel R., and Gross G., 1986. Carbonic anhydrase in
the sarcoplasmatic reticulum of rabbit sceletal muscule. J. Physiol., 371:
351-364.
8-Flik G., Verbost P.M., Atsma V., and Lucu C.,1994. Calcium transport
in gill plasma membrane of the shore crab Carcinus maenas: evidence for
carriers driven by ATP and a Na
+
-gradient. J. Exp. Biol., 185: 109-123.
Fig. 1. Specific activities of carbonic anhydrase (CA) in epipodite, bran-
chiostegite and gills of lobsters Homarus gammarusacclimated to sea-
water (SW) and to dilute seawater (DSW).
Mean values for 6 individual samples are given, error bars indicated SE.
Asterisks denote significant differences from the SW value (Student’s t-test
p>0.001).