Rapp. Comm. int. Mer Médit., 37,2004
288
GROWTH AND MORTALITY RATES OF HIGH-DNA AND LOW-DNA-BACTERIA
IN SURFACE AND DEEP CHLOROPHYLL MAXIMUM LAYERS
Renate Scharek
1,2*
and Mikel Latasa
1
1
Institut de Ciencies del Mar (ICM, CSIC), Passeig Marítim de la Barceloneta, 37-49, E-08003 Barcelona, Spain
2
Instituto Español de Oceanografía (IEO) Centro Oceanográfico de Gijón, Avda. Principe de Asturias, 70 bis E-33212 Gijón, Spain
* rscharek@icm.csic.es
Abstract
Protozoan grazing on marine heterotrophic bacteria was measured in summer 1999 in northwestern Mediterranean coastal waters. Serial
dilution experiments were performed with water of the surface and deep chlorophyll maximum layer (DCM). Measured growth and
grazing rates indicate that high-DNA-bacteria being the most active component of the bacterial community in the surface layer, not only
with respect to production but also as a prey for grazers. However, this tendency was not observed in the DCM, insinuating profound
differences between both habitats in structure and functioning of the respective bacterial populations and microbial networks.
Key words: microbial foodwebs, dilution experiments, ?ow cytometry
Introduction
Heterotrophicbacteria constitute a fundamental component in
marine planktonic microbial foodwebs and in dynamics of marine
carbon ?uxes (1). Bacterial productivity and mortality are key
parameters to understand their population dynamics and therefore, the
role of bacteria in biogeochemical processes and ecosystem
functioning. One approach to measure bacterial net growth and
mortality by bacterivory is to modify the encounter rates between
predator and prey applying the dilution method (2), which
manipulates the microbial community as a whole. Flow cytometrical
measurements combined with nuclear staining allow to obtain
indications about the DNA content of bacterial populations (3). This
parameter can give information about distinct assemblages and/or
their physiological status. We combined both methods in order to
measure growth and grazing rates for heterotrophic bacterial
populations during a cruise along the northwestern Mediterranean
coast (Catalunya, Spain). Our results provide new insights into the
growth dynamics of bacterial populations and how they are affected
by grazing in distinct habitats of the water column.
Material and methods
During the cruise ARO-2000 (May 30 - June 9, 2000) growth and
grazing rates were determined with the seawater dilution method at
stations situated in the frontal slope-edge-current. Eight experiments
were done with water from the surface (5m) and four experiments
with water from the DCM. Water was obtained by means of a
modified 30 L Niskin
®
bottle. Temperature and light conditions were
simulated on deck with a cooling system and a blue Plexiglas
incubator.
High and low-DNA-bacteria were quantified ?ow-cytometrically
after staining with DNA stain Syto 13 (Molecular Probes).
Significance of differences of calculated growth and grazing rates
between high and low-DNA-bacteria from the surface and DCM was
tested with the t-test (4).
Results and discussion
A freshened surface current in the frontal zone extended to about 10
m, and sometimes 20 m, depth carrying water in?uenced by the
Rhone river. Between 5 m and DCM depth, a temperature decrease of
5 to 6°C was measured. The DCM was located between 40 and 70 m
and coincided with the lowest part of the thermocline. Chlorophyll
?uorescence intensities were between 3 and 22 times higher in the
DCM than in the surface layer.
Concentrations of total bacteria at the beginning of the experiments
ranged between 0.8 and 2.5 10
6
ml
-1
in the surface and between 1.2
and 1.7 10
6
ml
-1
in the DCM. In the surface layer, proportions of high-
DNA-bacteria to total bacterial concentrations varied between 34 and
55%. In the DCM, the high-DNA-bacteria proportions were slightly
lower (39 to 47%).
Bacterial concentrations at the end of the experiments did not differ
considerably from the ones at the beginning indicating a match
between growth and grazing.
Intrinsic total bacterial growth rates ranged from 0.44 to 1.64 d
-1
in
the surface and from 0.49 to 1.19 d
-1
in the DCM. Average grazing
rates on the bacterial community ranged from 0.74 to 1.29 d
-1
in the
surface and from 0.32 to 1.02 d
-1
in the DCM. Different rates were
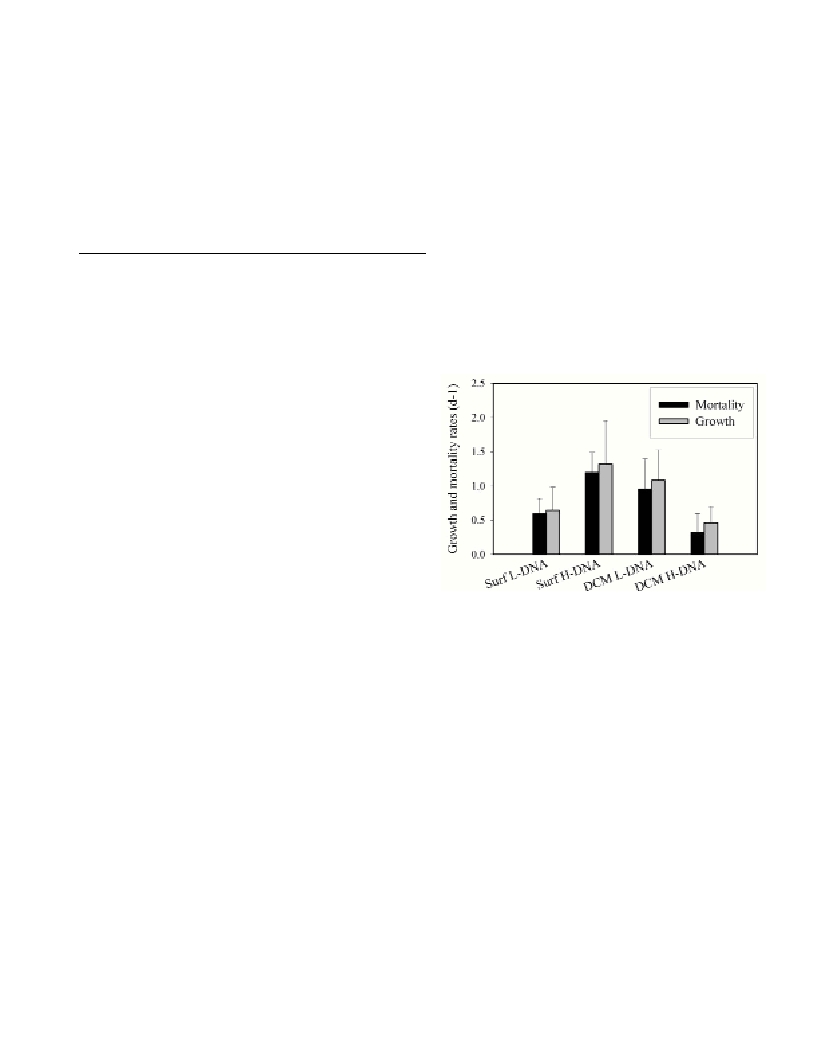
measured for high-DNA and low-DNA-bacteria populations. In the
surface, average grazing and growth rates of high-DNA-bacteria were
twice as high as those of low-DNA-bacteria. In the DCM, the
opposing trend was apparent: average grazing rates on high-DNA-
bacteria were about a third of the rates on low-DNA-bacteria and
average intrinsic growth rates were about half.
Average grazing rates on high-DNA-bacteria were nearly four
times higher in the surface than in the DCM and average intrinsic
growth rates were nearly three times higher. Average grazing rates on
low-DNA-bacteria and their growth rates were higher in the DCM
compared to the surface, however, not significantly (Fig.1).
Fig. 1. Growth and mortality rates of high-DNA and low-DNA-bacteria in
the surface and the DCM. Indicated are arithmetic means and one stan-
dard deviation.
A strong coupling between intrinsic growth and grazing rates was
observed in both layers and in both bacterial fractions. As a result,
bacterial concentrations and proportions between high-DNA and low-
DNA-bacteria remained more or less the same.
Our observations provide evidence for the hypothesis that high-
DNA-bacteria are the most active component of the bacterial
community (5). Nevertheless this trend presented itself only in the
surface layer, as in the DCM the opposing tendency was apparent.
Besides the measured differences in bacterial growth and mortality
rates, the properties of the different layers, coastal river-plume at the
surface versus typical oceanic DCM, insinuate distinct phylogenetic
affiliations of the bacterial populations and dissimilarities of the
microbial foodwebs.
References
1-Pomeroy L.R., 1974. The ocean´s food web, a changing paradigm.
BioScience, 24: 499-504.
2-Landry, M.R., and Hasset, R.P. 1982. Estimating the grazing impact of
marine microzooplankton. Marine Biology, 67: 283-288.
3-Li W.K.W., Jellett J.F., and Dickie P.M., 1995. DNA distributions in
planktonic bacteria stained with TOTO or TO-PRO. Limnol. Oceanogr.,
40: 1485-1495.
4-Sokal R.R., and Rohlf F.J. 1981. Biometry. W.H. Freeman and
Company, New York: 859 p.
5-Gasol J.-M., Zweifel U.L., Peters F., Fuhrman J. A., and Hagström A.,
1999. Significance of size and nucleic acid content heterogenity as
measured by ?ow cytometry in natural planktonic bacteria. Appl. Environ.
Microbiol., 65: 4475-4483.