Rapp. Comm. int. Mer Médit., 37,2004
289
BACTERIAL BIOMASS IN SEDIMENTS OF COASTAL ADRIATIC SEA
S. Šestanovic*, M. Šolic and N. Krstulovic
Institute of Oceanography and Fisheries, Split, Croatia - * sesta@izor.hr
Abstract
The changes in bacterial biomass and morphological diversity of bacterial cells were studied in sediments of the eastern middle Adriatic
Sea. Bacterial biomass showed seasonal changes, varying from 78 to 378 mg C g
-1
. Rods dominated bacterial biomass during the whole
year. The majority of cocci biomass consisted of cells with the volume between 0.01 -0.5 mm
3
. During January and December, filamentous
bacteria covered up to 17% bacterial biomass.
Key words: bacterial biomass, sediment, Adriatic Sea
Introduction
Sediment bacteria comprise a large fraction of total benthic
biomass. To elucidate their trophic role, accurate measurements of
their biomass are needed. The changes in bacterial biomass depend
upon environmental conditions. Nutrient limitations can lead to the
formations of ultramicrocells (1). Under heavy protozoan grazing, the
distribution of bacterial cell types may shift toward filamentous forms
resistant to grazing (2).
Materials and methods
Undisturbed sediment cores were collected monthly, from January
to December 2002, with a piston corer, at one coastal station in
Kaštela Bay, middle Adriatic Sea. Bacteria were counted and sized
under epi?uorescent microscope (3). The volume of each cell was
calculated following equation of (4). Cell volumes were converted to
bacterial biomass using the equation given by (5). The results were
expressed in grams of sediment dry weight.
Results
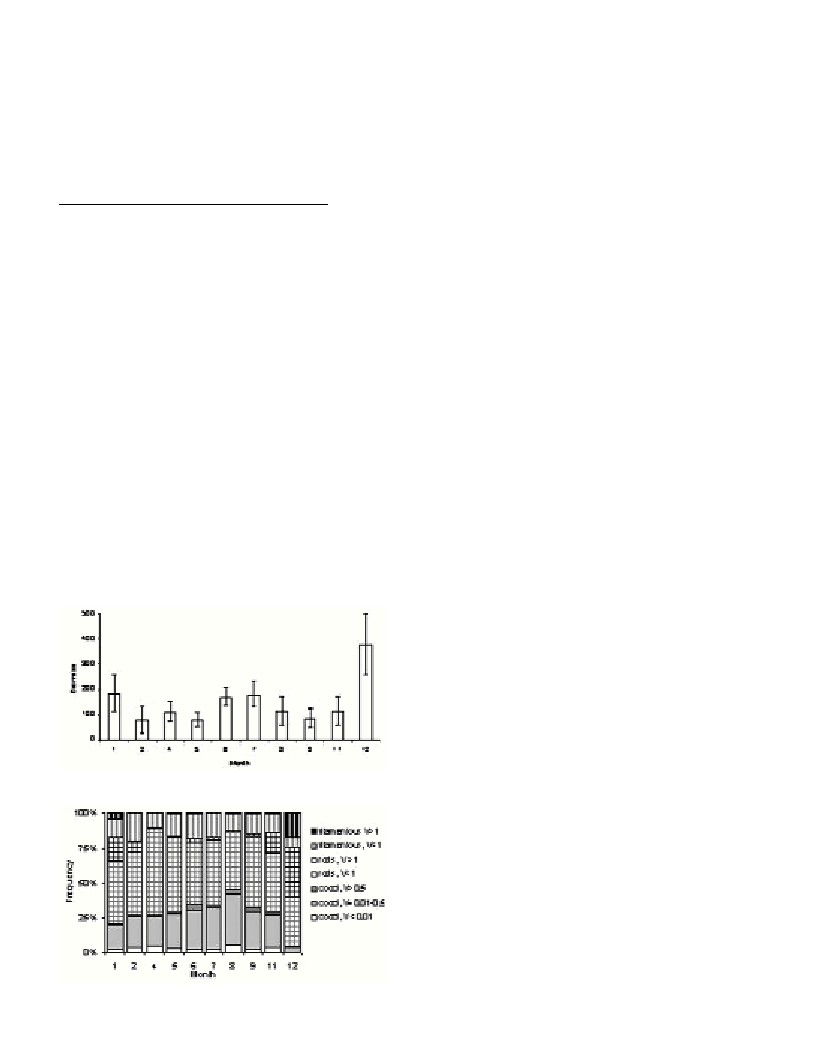
Bacterial biomass ranged from 78 to 378
µ
g C g
-1
(Fig. 1). Rods
dominated bacterial biomass during the whole year, especially during
winter, covering 61 -72% of bacterial biomass (Fig. 2). During non-
winter period rods smaller than 0.5
µ
m
3
prevailed. Rods larger than
1
µ
m
3
dominated during winter. The importance of cocci increased
during warmer months when they accounted for up to 45% of
bacterial biomass. The majority of cocci biomass consisted of cells
with the volume between 0.01 -0.5
µ
m
3
. Filamentous bacteria covered
10 -24% of bacterial biomass. During the non-winter period, their
biomass mainly consisted of cells smaller than 1
µ
m
3
. During January
and December, a shift toward cells larger than 1
µ
m
3
occurred. In that
period, those cells covered up to 17% of bacterial biomass.
Fig. 1. Monthly distribution of bacterial biomass (mean ±1 SD)
(
µ
g C g
-1
).
Fig. 2. The contribution of different size classes of bacteria in bacterial
biomass (V= volume in
µ
m
3
).
Discussion
Bacterial biomass was one order of magnitude higher than values
reported in other coastal areas of the Mediterranean Sea (6). Our study
indicates annual patterns of bacterial biomass changes.
The size and shape of bacterial cells are affected by the conditions
in the environment. The quality and quantity of available organic
matter, temperature and grazing pressure, can provoke changes in cell
morphology. As opposite to water column, where protozoan predation
exerts a major in?uence on bacterial biomass, in benthic environments
grazing has no considerable impact on bacterial dynamics. According
to (7), the major parameter that determines the distribution of bacteria
and ?agellates in sediments is the size of sediment particles. The
decrease of sediment grain size is accompanied with decrease in
bacterial production and increase in ?agellate biomass. Therefore,
?agellates could have a stronger control over bacterial dynamics only
when bacterial production is minimal. In order to reveal the
importance of predation for bacteria in sediments of coastal Adriatic
Sea, it would be essential to elucidate the changes in bacteriovorous
protozoa abundance, as well as in benthic bacterial production. The
future investigations will focus on these problems.
References
1-Šimek, K.,Vrba, J., Pernthaler, J., Posch, T., Hartman, P., Nedoma, J.
and Psenner, R., 1997. Morphological and compositional shifts in an
experimental bacterial community in?uenced by protists with contrasting
feeding modes. Appl. Environ. Microb.,63: 587-595.
2-Holmquist, L. and Kjellember, S., 1993. Changes in viability,
respiratory activity and morphology of marine Vibrio sp. Strain S14 during
starvation of individual nutrients and subsequent recovey. FEMS
Microbiology Ecology, 12: 215-224.
3-Hobbie, J.E., Daley, R.J. and Jasper, S., 1977. Use of nucleopore filters
for counting bacteria by ?uorescence microscopy. Appl. Environ. Microb.,
33: 1225-1228.
4-Bratbak, G., 1985. Bacterial biovolume and biomass estimations. Appl.
Environ. Microb., 49: 1488-1493.
5-Norland, S., 1993. The relationship between biomass and volume of
bacteria. Pp. 303-309. In: P.F. Kemp, B.F. Sherr, E.B. Sherr, and J.J. Cole
(eds.), Handbook of methods in aquatic microbial ecology. Boca Raton,
Lewis Publishers.
6-Mirto, S., La Rosa, T., Danovaro, R. and Mazzola, A., 2000. Microbial
and meiofaunal response to intensive mussel-farm biodeposition in coastal
sediments of the western Mediterranean. Mar. Pollut. Bull.,40: 244-252.
7-Hamels, I., Muylaert, K., Casteleyn, G. and Vyverman. W., 2001.
Uncoupling of bacterial production and ?agellate grazing in aquatic
sediments: a case study from and intertidal ?at. Aquatic Microbial
Ecology,25: 31-42.