Rapp. Comm. int. Mer Médit., 37,2004
296
INFLUENCE OF SMALL INCREASES IN TEMPERATURE ON PLANKTONIC BACTERIAL CARBON USE
IN THE BLANES BAY (COASTAL NW MEDITERRANEAN)
Evaristo Vázquez-Domínguez*, Josep M. Gasol, Dolors Vaqué and Marta Estrada.
Institut de Ciències del Mar, CMIMA-CSIC, Passeig Marítim de la Barceloneta 37-49, Barcelona, Spain
Abstract
Bacterial production (BP) and respiration (BR) were measured seasonally in a Mediterranean coastal area (Blanes Bay) at two
temperatures: ambient temperature (TA) and about two degrees above that temperature (T+2). Seawater samples were filtered through 0.8
µ
m to obtain a predator-free bacterioplankton assemblage and incubated for 48 hours at both temperatures. From production and
respiration rates we derived bacterial growth efficiency (BGE). Production and respiration rates were positively affected by the increase in
temperature, while BGE remained unchanged. Therefore, small increases of temperature might increase the amount of carbon passing
through bacteria.
Keywords: Bacterial production. Bacterial respiration. Bacterial growth efficiency. Temperature.
Introduction
Due to human industrialization and deforestation the concentration
of CO
2
has increased in the atmosphere [1], and this is expected to
lead to an increase in Earth’s average temperature of ~ 2.5 ºC in a
century [2]. Temperature has an extremely important in?uence on
biological processes such as bacterial production and respiration [3,
4]. As microbes are relevant actors in the transfer of carbon in aquatic
ecosystems [5], there is an increasing interest in the effect of small
temperature increases on microbial plankton [6]. The objective of this
study is to test the effect of small increases in temperature (ca. 2ºC)
on bacterial carbon use and growth efficiency in an oligotrophic
coastal system (NW Mediterranean) and its implications for the
planktonic carbon cycle.
Methodology
Experiments were done monthly (March-August 2003) with
subsurface seawater collected from a fixed station in Blanes bay (41º
39’N, 2º 48’E), over 15 m depth and about half mile offshore.
Seawater temperature was determined with a calibrated thermometer,
and 25 liters were pre-filtered through 200
µ
m, placed on a carboy,
and transported to the laboratory. The samples were then filtered
through 0.8
µ
m (AAWP, Millipore), bacterial production rates
determined by
3
H-Leucine uptake [8] and converted to bacterial
carbon with a standard factor of 3.1 Kg C mol
-1
. Filtered water was
also distributed in 48 borosilicate glass bottles (ca. 130 ml), of which
8 were immediately fixed with Winkler reagents (t0). The remaining
bottles were placed in two temperature-controlled chambers, set at
ambient temperature (TA) and ~ 2 degrees above this temperature
(T+2). At 24 and 48 hours we fixed the remaining 40 bottles, 10 each
time for each temperature. Dissolved oxygen was determined with an
automatic titrator based on potentiometric endpoint detection [7].
Respiration rates were obtained by linear regression of oxygen
concentration vs. time, and were transformed to carbon units
assuming a respiration quotient of 1. Bacterial carbon use is BP+BR
and bacterial growth efficiency (BGE) is BP/(BP + BR) [9].
Results and discussion
Seawater temperature varied twelve degrees in Blanes bay, between
13 ºC in March and 25 ºC in August. Initial bacterial productions
varied between 1.3
µ
g C l
-1
d
-1
in June and 150
µ
g C l
-1
d
-1
in July,
increasing exponentially at 24 hours during the incubations and
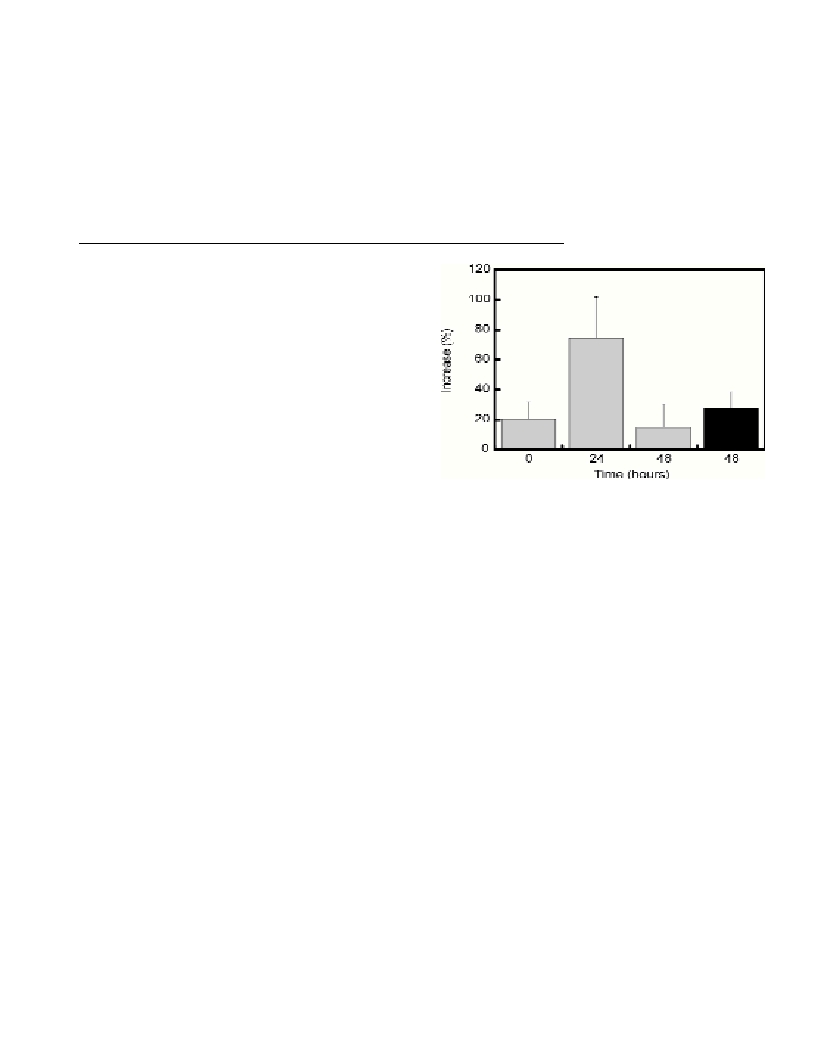
showing a clear shift-up in the T+2 samples (Fig. 1), The average
increase of bacterial production ((BP
TA
- BP
T+2
)/ BP
TA
) was 36 (±
12) %. BP’s at both temperatures were positively correlated, BP
T+2
=
15.3 (±20.3) + 1.1 (±0.1) BP
TA
(n = 18, r
2
= 0.8, p< 0.01).
Respiration rates at ambient temperatures varied between 9.2
µ
g C l
-1
d
-1
in May and 102.1
µ
g C l
-1
d
-1
in March. The average increase of
respiration rates at the higher temperature was 27 (±11) %. Both
respiration rates were significantly related, BR
T+2
= 3.2 (±2.7) + 1.1
(±0.05) BR
TA
(n = 18, r
2
= 0.99, p< 0.01). Finally, bacterial growth
efficiencies varied between 4.7 and 95 %, , and were not in?uenced
by the small increase in temperature, BGE
T+2
= 4.5 (±3.7) + 0.95
(±0.05) BGE
TA
(n = 18, r
2
= 0.95, p< 0.01). Adding the values up, it
can be calculated that a small temperature increase could enhance
bacterial carbon use by near a 60 %.
We obtained experimental data that agree with modeling studies in
which small increases in temperature had a positive effect on bacterial
production, respiration and carbon demand [3, 4], but no in?uence on
BGE [9]. Therefore, small changes in temperature will have an effect
on the microbial components of aquatic systems [6] significantly
increasing the amount of carbon processed by bacteria.
Fig. 1. Average increase in BP and BR at time 0, 24 and 48 hours (BP,
gray columns) and during 48 hours (BR, black column).
Acknowledgments
This research was funded by RED2002, REN2001-0588/ANT and
EVK3-CT-2002-00078 BASICS. Special thanks to J. Pinhassi and L.
Alonso for help in the rad-lab.
References
1-Siegentaler U. and Sarmiento J.L. Atmospheric carbon dioxide and the
ocean. Nature, 365: 119-125.
2-Houghton J., 1997. Global warming: the complete briefing. 251 pp. In:
Houghton J. (ed.), Cambridge University Press. Cambridge, U.K.
3-Pomeroy L.R. and Wiebe W.J., 2001. Temperature and substrates as
interactive limiting factors for marine heterotrophic bacteria. Aquat.
Microb. Ecol.,23: 187-204.
4-Rivkin R.B. and Legendre L., 2001. Biogenic carbon cycling in the
upper ocean: Effects of microbial respiration. Science, 291: 2398-2400.
5-Azam F., Fenchel T., Field J.G., Gray J.S., Meyer-Reil L.A., Thingstad
F., 1983. The Ecological Role of Water-column Microbes in the Sea. Mar.
Ecol. Prog. Ser., 10: 257-263
6-Petchey O.L., McPhearson P.T., Casey T.M., Morin P.J., 1999.
Environmental warming alters food-web structure and ecosystem
function. Nature, 402: 69-72.
7-JGOFS. (Joint Global Flux Study) 1994. Protocols for the JGOFS core
measurement. In: Knap A., Michaels A., Close A., Ducklow H., Dickson
A. (eds.) JGOFS Rep. No 19.
8-Smith D.C. and Azam F., 1992. A simple, economical method for
measuring bacterial protein synthesis rates in seawater using
3
H-leucine.
Marine Microbial Food Webs, 6: 107-114.
9-del Giorgio P.A. and Cole J.J., Bacterial growth efficiency in natural
aquatic systems. Annu. Rev. Ecol. Syst.,29: 503-541.