ABUNDANCE AND BIOMASS OF NONLORICATE CILIATE POPULATIONS
IN KASTELA BAY (ADRIATIC SEA)
Natalia Bojanic
Institute of Oceanography and Fisheries, Split, Croatia - bojanic@izor.hr
Abstract
Seasonal distributions of nonloricate ciliates (NLC) density and biomass were investigated in the north-eastern part of the KaštelaBay,
Croatia. The highest NLC abundance (2040 ind.l
-1
) and biomass (6.844
µ
gC l
-1
) were recorded in June 1999 at the surface, and in October
1999 at 10 m depth, respectively.
Keywords: zooplankton, biomass, Adriatic Sea
Rapp. Comm. int. Mer Médit., 37,2004
315
Introduction
Ciliated protozoa are undoubtedly an important component in
marine ecosystems, because they participate in the ?ow of energy and
carbon from bacterioplankton and phytoplankton to large zooplankton
organisms [1, 2]. On the other hand, phytoplankton releases the
dissolved organic matter, which is returned to the main food chain via
the “microbial loop” [3]. In such circumstances ciliated protozoa
could act as a link between classic herbivorous food chains and
microbial food web [4]. Due to those reasons, the study of temporal
?uctuations of nonloricate ciliate (NLC) abundance and biomass in
the north-eastern part of Kaštela Bay has been carried out. These are
the first results for this part of the Bay as well as the biomass data, that
are one of very few available for the whole Adriatic Sea.
Material and methods
Samples were collected at one station (43°32.5’N; 16°24.4 E), on
a monthly basis from July 1998 until November 1999, at 0, 5, 10 and
28 m depth, using 1.7 l Nansen bottles (Fig.1). Organisms were
preserved in buffered formaldehyde, final concentration 2.5%. The
material was sedimented, decanted down to 20 ml [5] and counted
using microscope at magnifications of x200 and x400. The biovolume
of nonloricates (NLC) was calculated applying the geometrical
method. After measurement of organism dimensions, NLC popu-
lations were divided into four size categories: NLC I <10
3
µ
m
3
, II –
10
3
-10
4
µ
m
3
, III – 10
4
-10
5
µ
m
3
, IV >10
5
µ
m
3
. Conversion factor used
to transform these volumes into carbon biomass values was
0.14 pgC
µ
m
-3
[6].
Fig. 1. Study area (Kastela Bay) with the sampling station.
Results and discussion
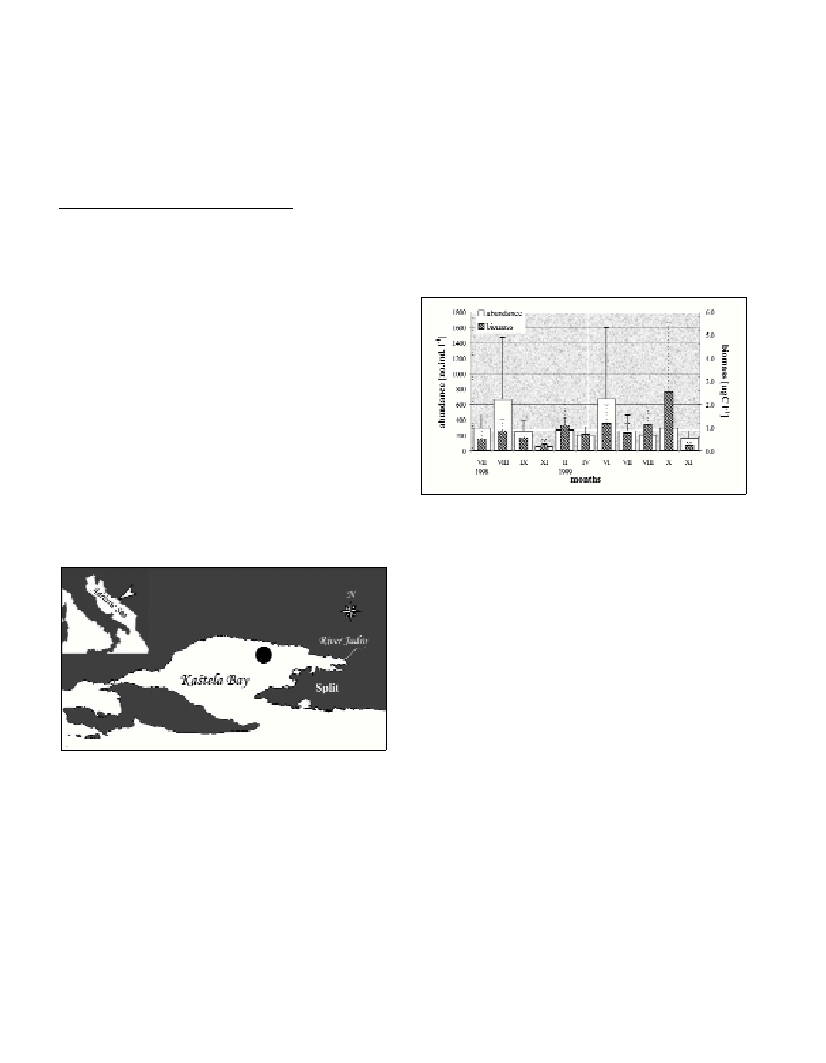
Seasonal distribution of nonloricate (NLC) abundance showed the
highest density during the summer, with the maximum of 670±928
ind.l
-1
in June 1999. In the remaining period of the year average
density values were less then 290 ind.l
-1
(Fig.2). The majority of
NLC populations (72%) remained in the layer above 5 m depth and
the highest abundance of 2040 ind.l
-1
was noticed at the surface
in June 1999, when was recorded the intensive in?ow of fresh
water. Such ?uctuations corresponded with variability of NLC II
(10
3
-10
4
µ
m
3
) that contributed to the total NLC number with 50%.
High summer NLC abundance is characteristic of eutrophicated
ecosystems [7].
Biomass of NLC varied from 0.233±0.267 to 2.544±3.013
µ
gC l
-1
in November 1998 and October 1999, respectively (Fig. 2). The
values were rather uniformly distributed (<1,623
µ
gC l
-1
) from July to
November 1998. The period from February to July 1999 was
characterised by increase of biomass in the upper 5 m, where ~60% of
NLC biomass were concentrated. In October 1999 was recorded the
highest biomass of 6.844
µ
gC l
-1
at 10 m depth. This variability was
particularly affected by NLC >10
4
µ
m
3
, which participate in total
NLC biomass with 87%. Similar biomass data are found in the Gulf
of Trieste [8].
Fig. 2. Temporal variability in abundance and biomass of nonloricates in
the Kastela Bay.
High abundance and biomass values of NLC populations point the
importance of these organisms in the secondary production of the
KaštelaBay.
References
1-Bernard C., Rassoulzadegan F., 1993. The role of picoplankton
(cyanobacteria and plastidic pico?agellates) in the diet of tintinnids.
J.Plankton Res., 15: 361-373.
2-González J.M., 1999. Bacterivory rate estimates and fraction of active
bacterivores in natural protist assemblages from aquatic systems. Appl.
Environ. Microbiol., 65: 1463-1469.
3-Azam F., Fenchel T., Field J.G., Gray J.S., Meyer-Reil L.A., Thingstad
F., 1983. The ecological role of water - column microbes in the sea. Mar.
Ecol. Prog. Ser., 10: 257-263.
4-Bojanic N., Šolic M., Krstulovic N., Marasovic I., Nincevic Ž.,
VidjakO.,2001. Seasonal and vertical distribution of the ciliated protozoa
and micrometazoa in KaštelaBay (central Adriatic). Helgol. Mar. Res., 55:
150-159.
5-Kršinic F.,1980. Comparison of methods used in micro-zooplankton
research in neritic waters of the Eastern Adriatic. Nova Thalassia., 4: 91-
106.
6-Putt M., Stoecker D.K., 1989. An experimentally determined
carbon:volume ratio for marine “oligotrichous” ciliates from estuarine and
coastal waters. Limnol. Oceanogr., 34: 1097-1103.
7-Revelante N., Gilmartin M., Smodlaka N., 1985. The effects of Po
River induced eutrophication on the distribution and community structure
of ciliated protozoan and micrometazoan populations in the northern
Adriatic Sea. J. Plankton Res., 7: 461-471.
8-Lipej L., 1992. Mikrozooplankton v prehranjevalni verigi južnega dela
Tržaškega zaliva. MS thesis, University of Zagreb, Croatia.