ASSESSMENT OFCALANUS HELGOLANDICUS EMBRYO
AND NAUPLIAR MORTALITY USING FLUORESCENT PROBES
Isabella Buttino
1
*, Giovanna Romano
1
, Maristela do Espirito Santo
1,2
, Adrianna Ianora
1
and Antonio Miralto
1
1
Stazione Zoologica “Anton Dohrn”, Napoli, Italy - * buttino@szn.it
2
CRIAcq Centro di Ricerca Interdipartimentale per l’acquacoltura, Portici, Napoli, Italy
Abstract
A diatom diet of Thalassiosira rotula and Skeletonema costatuminduced egg mortality and abnormal development of hatched copepod
Calanus helgolandicusnauplii, depending on the number of ingested cells and the duration of feeding. Here we use ?uorescent techniques
to evaluate copepod embryo mortality following spawning, using the vital probe SYTOX Green, and to assess apoptosis in abnormal
nauplii using the TUNEL enzymatic assay.
Key-words: Copepod; vital ?uorescent probes; apoptosis
Rapp. Comm. int. Mer Médit., 37,2004
324
In recent years it has been shown that several species of diatoms
produce
a-ß
unsaturated aldehydes that block embryonic divisions in
various species of invertebrates, including copepods (1-3). The
cellular target of these molecules is still unknown but previous studies
have demonstrated that decadienal, one of the main unsaturated
aldehydes isolated from diatoms, depolymerises microtubules and
actin filaments in sea urchin and tunicate embryos (1;4) and induces
apoptosis in copepod and sea urchin embryos (5). When copepods
feed a diatom diet, egg viability is reduced in a time and concentration
dependent manner (5;6). At lower diatom concentrations, some
embryos develop to hatching but the embryos thus generated are
strongly malformed
(6)
. Here we apply two different ?uorescent
techniques to study the effect of diatom diets on the reproductive
physiology of the copepod Calanus helgolandicus: a protocol to
rapidly calculate embryo mortality soon after spawning, using the
vital ?uorescent probe SYTOX Green (Molecular probes), and an
enzymatic in-situlabeled nucleotide assay (dUTP nick-end labelling,
TUNEL) to evaluate the induction of apoptosis in abnormal nauplii.
SYTOX Green is a non-permeant nucleic acid stain that enters only
into cells with damaged plasma membranes such as in dead cells that
then appear with green ?uorescent nuclei. Calanus helgolandicus
embryos, produced by females fed the diatom Thalassiosira rotula,
were incubated in chitinase solution (1U/ml for 50 min at 20°C) to
permeabilize the chitinous wall soon after egg spawning. Embryos
were then incubated in SYTOX Green 20 µM for 50 min, and
observed with the epifluorescent or confocal laser scanning
microscope. Egg mortality was determined as the number of
fluorescent as opposed to non-fluorescent embryos. DNA
fragmentation due to apoptosis was detected with the TUNEL kit
(Boheringher GmbH) on abnormal C. helgolandicusnauplii produced
by females fed the diatom Skeletonema costatum.
Eight days after feeding, percentage egg mortality increased to 75%
when embryos were allowed to develop naturally to hatching (Fig. 1
control). SYTOX Green-treated embryos gave similar results for
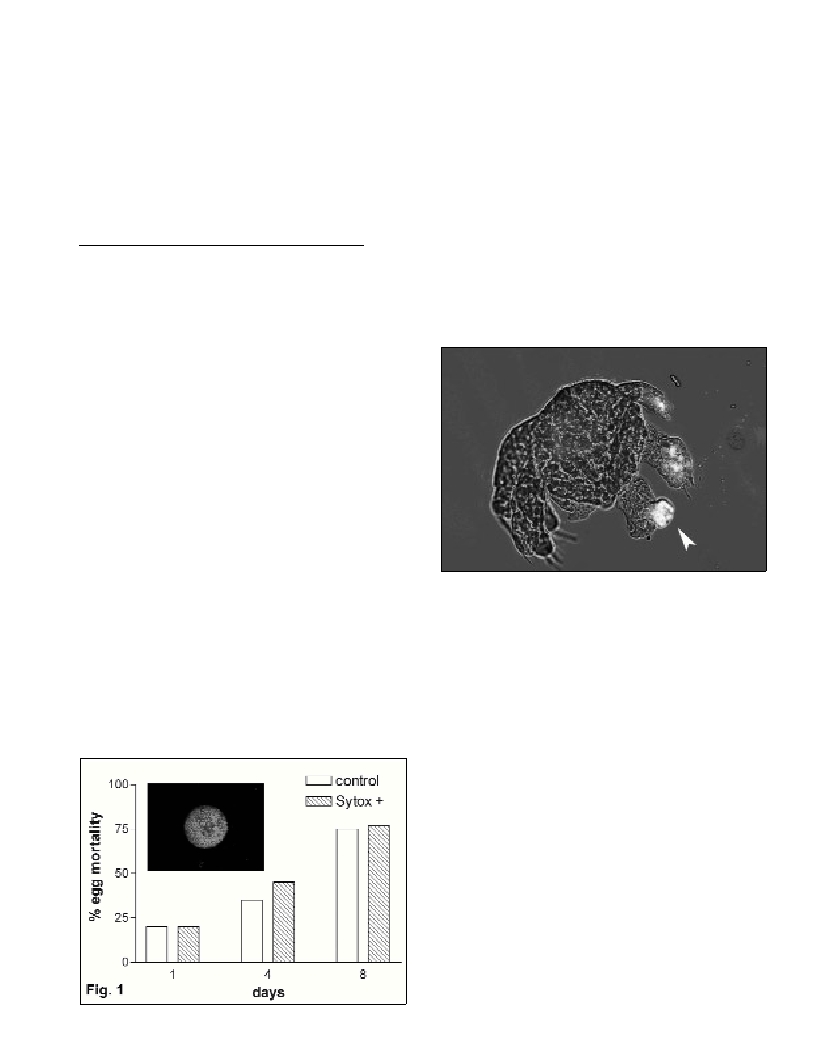
embryo mortality (Fig. 1 Sytox + and insert). Figure 2 shows a
deformed nauplius positively stained with TUNEL (arrow) indicating
activation of apoptotic processes in abnormal tissues. Such nauplii die
soon after hatching.
The possibility of applying immuno-?uorescence techniques to
stain embryos and nauplii opens new perspectives in studies on the
reproductive physiology of copepods and zooplankton, allowing for
the rapid assessment (2h) of hatching success and abnormal
embryonic and post-embryonic development compared to other
conventional techniques.
Fig. 2.
References
1-Buttino I., Miralto A., Ianora A., Romano G., Poulet S.A., 1999. Water
soluble extracts of the diatom Thalassiosira rotulainduce aberrations in
embryonic tubulin organisation of the sea urchin Paracentrotus lividus.
Mar. Biol.,134: 147-154.
2-Miralto A., Barone G., Romano G., Poulet S.A., Ianora A., Russo G.L.,
Buttino I., Mazzarella G., Laabir M., Cabrini M., Giacobbe M.G., 1999.
The insidious effect of diatoms on copepod reproduction. Nature402:
173-176.
3-Pohnert G., 2000. Wound-activated chemical defense in unicellular
planktonic algae. Angew Chem Int Ed., 39:4352- 4354.
4-Tosti E., Romano G., Buttino I., Cuomo A., Ianora A., and Miralto A,
2003. Bioactive aldehydes from diatoms block fertilisation currents in
ascidian oocytes. Mol. Reprod. Dev.66: 72-80.
5-Romano G., Russo G.L., Buttino I., Ianora A., Miralto A., 2003. A
marine diatom-derived aldehyde induces apoptosis in copepod and sea
urchin embryos. J. Exp. Biol. 206: 3487-3494.
6-Poulet S., Laabir M., Ianora A., Miralto A., 1995. Reproductive
response of Calanus helgolandicus. I. Abnormal embryonic and naupliar
development. Mar. Ecol. Prog. Ser.129: 85-95.