EFFECTS OF UVC RADIATION ON SURVIVAL OF ARTEMIACYSTS
AND NAUPLII (CRUSTACEA, BRANCHIOPODA)
Marija Crncevic
1*
, Melita Peharda
2
, Jakša Bolotin
3
, Slaven Dobrovic
4
, Adam Benovic
3
, Ana Bratoš
1
, Valter Kožul
3
,
Nikša Glavic
3
, Pero Tutman
2
, Josip Lovric
1
, Nikola Ružinski
4
1
Collegium Ragusinum, Dubrovnik, Croatia - * marijica1@netscape.net
2
Institute of Oceanography and Fisheries, Split, Croatia
3
Institute of Oceanography and Fisheries, Dubrovnik, Croatia
4
Faculty of Mechanical Engineering and Naval Architecture, University of Zagreb, Croatia
Abstract
The objective of this research was to examine the potential of UVC radiation (254 nm) to kill organisms in ballast water, using brine shrimp
Artemia naupliiand their resistant resting cysts as model organisms. Brine shrimp nauplii could be killed using UV radiation, while cysts
were found to be more resistant.
Key words: Artemia, ballast water, UV radiation
Rapp. Comm. int. Mer Médit., 37,2004
338
Introduction
The movement of ship’s ballast water is currently the most
important source of marine species transfers throughout the world,
posing a serious threat to biodiversity, economy and human health (1,
2, 3). Land-locked Adriatic Sea can be influenced by such
introductions (4). Authorities of some Croatian ports are looking into
possibilities of expanding their current activities and there are
indications that a vast quantities of ballast waters will be discharged
in the North Adriatic Sea in a very near future.
The most effective solution for reducing transfer of alien species is
treatment of ballast water (5). Ultraviolet radiation (UV) is an
environmentally benign approach (6) that produces no significant
residual toxicants. It is already present at many re-circulating water
aquaculture operations as a means of improving water quality (7).
This study was designed to evaluate the potential of UV to kill cysts
and naupliiof brine shrimp Artemia.
Material and methods
The experimental assembly, consisted of batch type UV
disinfection units with centrally placed source of UV light, protected
from water with quartz tube. The light source of every unit was single
low-pressure mercury lamp at 254 nm. UV intensity was kept constant
(40 µW/cm
2
) and the UV dose was calculated as the product of
intensity (µW/cm
2
) and exposure time (s). Absorbance at 254 nm was
A=0.06 and was measured in spectrophotometer HP 8453 using 1 cm
quartz cuvette. Exposure columns were made of 50 cm tall glass
cylinders (8.8 cm inner diameter). In the experiment, simultaneously
run in triplicate, nauplii (6 ind/cm
3
) were exposed to different UV
dose levels: 2.4, 7.2, 12, and 19.2mWsec/cm
2
.Control nauplii
received air, at the same ?ow rate and exposure times, as the treatment
nauplii. Survival rates were estimated from manual counts of nauplii
in six replicate 1 cm
3
samples, collected from each exposure column
0, 60, 120 and 1440 min after UV exposure, to look at long–term
survival.
In experiments with cysts, Artemiacysts (2g/dm
3
) were placed in
each of two 2 dm
3
exposure columns (one treatment and one control).
Cysts were exposed to different UV dosages: 24, 72, 144, 432, 720,
and 1008 mWsec/cm
2
.After exposure, cysts were cultured at 27°C
and 15 psu for 24 h. Cyst survival rates were estimated from manual
counts of hatched nauplii in 10 replicate 1 cm
3
samples collected from
each exposure column.
Difference in survival among different treatments was tested using
Kruskal Wallis nonparametric analysis of variance.
Results and discussion
All experiments were performed at 23.5 - 24
°
C, 37.4 psu, and pH
8.15 - 8.18. Cyst viability ranged between 72.02% for UV dose 24
mWs/cm
2
and 11.78%for UV dose 1008 mWs/cm
2
. Statistically
significant differences were found for survival of cysts exposed to
different doses of UV radiation (p < 0.001, n = 60).
During preliminary experiments, 100 % brine shrimp nauplii
mortality was achieved by 24 mWs/cm
2
UV dose. Survival of nauplii
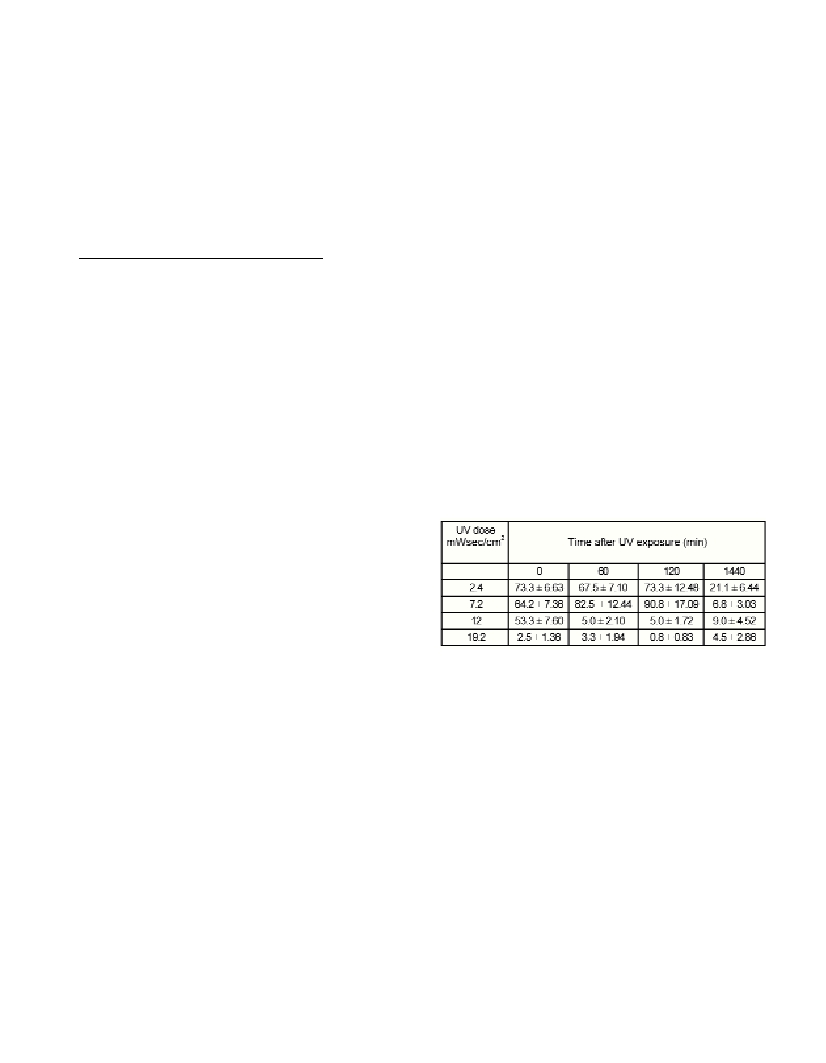
after UV exposure decreased significantly with increasing time after
exposure. The mean percent survival for an exposure time of 1min
(UV dose 2.4 mWs/cm
2
) was73.3%; immediately after exposure;
while after 24 hours of exposure it was only 21.1% (Table 1). There
was a statistically significant difference (p<0.001) in the long-term
survival of nauplii exposed to different UV dose levels.
Significant differences (p<0.001) in survival of nauplii were found
among treatments for different exposure time immediately after
treatment, 1 hour after treatment and 2 hours after treatment. There
was no significant difference in survival among treatments for
different exposure times 24 hours after (p = 0.157). The effectiveness
of UV in inactivating Artemiadepends on the life stage of the
organism. It has been shown that UV has a potential to kill nauplii
while cysts of Artemiaare much more resistant.
This research could be applied in future investigation of methods
for inactivation of different target organisms and their resting stages in
the ship’s ballast water. Investigation of UV treatment in real ballast
tank would be necessary because there may be mechanisms that can
change the possibility of UV species inactivation.
Table 1. Long – term survival * (mean ±SE) of brine shrimp nauplii
exposed to UV radiation
*Percent survival = mean of 100 X percent survival of each repli-
cate/mean of treatment control percent survival
References
1-Carlton J.T., 1985. Transoceanic and interoceanic dispersal of coastal
marine organisms: the biology of ballast water. Oceanogr. Mar. Biol. Ann.
Rev., 23: 313-371.
2-Golani D., Orsi-Relini L., Massuti E., and Quignard J.-P., 2002.
CIESM Atlas of Exotic species in the Mediterranean. Vol.1. Fishes.
(F.Briand, ed.). CIESM Publ., Monaco, 256 p.
3-Hallegraeff G.M., Bolch C.J., Bryan J. and Koerbin B., 1990.
Microalgal spores in ships’ballast water: a danger to aquaculture. Pp. 475-
480. In:Graneli E. et al.(ed.), Toxic Marine Phytoplankton. Elsevier, New
York.
4-Benovic A., Lovric J. and Ružinski N. 1995. Ballast waters: problems
andperspectives. Proceedings of the VII Congress of the International
Maritime Association of Mediterranean, pp. 440-446.
5-Oemcke D., 1999. The treatment of ships’ballast water. Ecoports
Monograph Series No. 18 (Ports Corporation of Queensland, Brisbane),
102 p.
6-Sutherland T.F., Levings C.D., Elliott C.C. and Hesse W.W., 2001.
Effect of a ballastwater treatment system on survivorship of natural
populations of marine plankton. Mar. Ecol. Prog. Ser., 210: 139-148.
7-Liltved H., Hektoen H., and Efraimsen H., 1995. Inactivation of
bacterial and viral fish pathogens by ozonation or UV irradiation in water
of different salinity. Aquacult. Eng., 14: 107-122.