PRELIMINARY ASSESSMENT OF TNT-EXPOSURE IN FISH
IN THE TREMITI ISLAND MARINE PROTECTED AREA
Della Torre C.
1
*, Alcaro L.
1
, Bonacci S.
2
, Corsi I.
2
, Farchi C.
1
, Giordano P.
1
, Penna M.
1
, Amato E.
1
, Focardi S
2
1
Istituto Centrale per la Ricerca scientifica e tecnologica Applicata al Mare (ICRAM), Roma, Italy - * camilla.dellatorre@tiscali.it
2
Dipartimento di Scienze Ambientali “G. Sarfatti”, Università degli Studi di Siena, Siena, Italy
Abstract
This study was performed to preliminarily assess the ecological risk due to the presence of 2,4,6-trinitrotoluene and its degradation
products in the marine environment. A multimarkers approach (EROD, AChE) was applied in specimens of Conger conger(Linnaeus,
1758) collected in the waters of Pianosa Island (TNT site) and in a reference site, S. Domino Island, in the same archipelago, the Tremiti
Islands Marine Protected Area (Adriatic Sea, Italy). Levels of TNT in fish tissues were also measured.
Keywords: biomarkers, TNT, Tremiti Islands, biomonitoring
Rapp. Comm. int. Mer Médit., 37,2004
343
Introduction
Disposal at sea of ordnance containing the explosive 2,4,6-
trinitrotoluene (TNT) represents a serious hazard to marine
ecosystems (1). The objectives of the present study were to obtain
preliminary data regarding the health of demersal fish species resident
in a TNT-impacted site and to test the possibility of using the sentinel
fish species Conger conger(Linnaeus, 1758) as a suitable bioindicator
to monitor the biological effect of TNT-exposure in aquatic
organisms.
Within the current research, Pianosa Island (Tremiti Islands Marine
Protected Area, Adriatic Sea, Italy) was chosen as the study area
because the seabed around the island has served as a dumping ground
for bombs since the Second World War.
Both a chemical approach, to detect traces of these products in fish
tissues, and a biomonitoring approach, aimed at detecting enzymatic
alterations by means of specific biomarkers, were applied.
Two well-established enzymatic responses currently used in
pollution monitoring and assessment were chosen: the 7-
ethoxyresorufin-O-deethylase (EROD) and Acetylcholinesterase
(AChE).
Materials and methods
Specimens of C. congerwere collected in June 2001 and 2002 both
in Pianosa Island and in a reference site in the same archipelago near
S. Domino Island (Tremiti Islands Marine Protected Area, Adriatic
Sea, Italy). The Fish tissues were examined for presence of TNT,
4ADNT and 2ADNT traces by means of a chromatographic assay (2),
as well as liver microsomal EROD activity (3), and
Acetylcholinesterase (AChE)activity in brain tissues (4). Total
protein contents were measured (5). Statistical analyses were carried
out using STATISTICA
®
Stat Soft5.0 software.Significant
differences between enzymatic values were assessed using the non
parametric Mann-Whitney test and results were considered as
statistically significant at p
<
0,05.
Results
No detectable levels of TNT or its degradation products were
observed in C. congertissues by means of the chromatographic assay.
AChE activities assayed in the brain were significantly lower in
specimens collected from the TNT-impacted site in both 2001 and
2002 compared to those measured in specimens collected in the
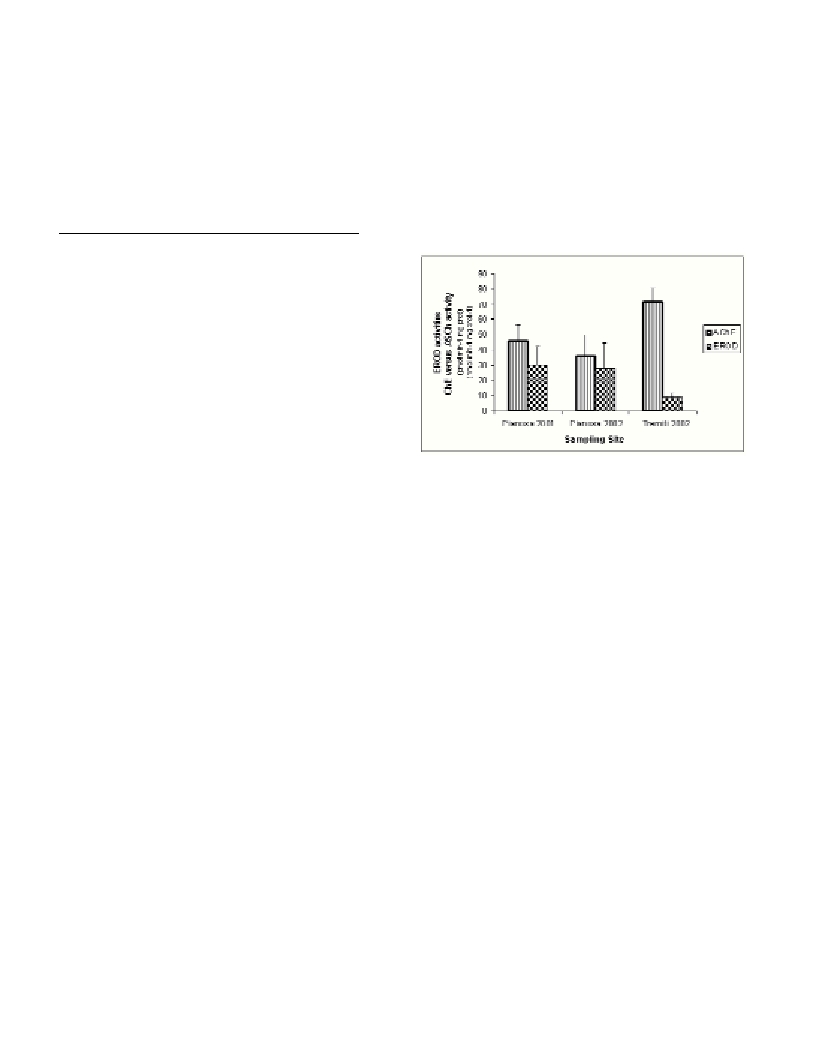
reference site. Significantly higher EROD activities were observed in
samples from the impacted area compared to those collected from the
reference site (Fig. 1).
The results of this preliminary study reveal a situation of instability
of the fish enzymatic systems. The lower AChE activities in
specimens from the TNT-impacted site suggest the presence of
neurotoxic compounds, like TNT (6), able to affect nerve impulse
transmission.
Moreover, the higher EROD activities observed in specimens from
the impacted site suggest potential biotransformation pathways for
TNT involving P-450 enzymes, as already suggested in previous
studies (7-9).
The metabolic alterations registered within the specimens collected
from Pianosa Island should be considered as a sign of exposure to
toxic compounds. However, the lack of data concerning the presence
of TNT or its degradation products within the tissues of the same
specimens, stresses the need of further information to verify the
responsibility of these products in altering enzymatic activities.
The current research presents preliminary data concerning
biomarkers of exposure and effect in C. conger, potentially very
useful for future ecotoxicological studies in the marine environment.
Fig. 1. EROD activities (pmol min-1 mg prot-1) in liver and ChE activity
versusASCh (nmol min-1 mg prot-1) in brain of C. congercollected in the
Tremiti Islands Marine Protected Area (Adriatic Sea, Italy). Values are
expressed as mean ±standard deviation (6<n<10).
Conclusions
The absence of detectable traces of TNT and its degradation
products in fish tissues confirms their low biodisponibility and
bioconcentration potential. The results of the multimarkers approach
however, taking into account the absence of local xenobiotics sources
in the uninhabited and protected island, reveal the existence of a
stressing condition that could be linked to the presence of these
molecules in the impacted site.
References
(1)-Lotufo G.R., Farrar D.J., Inouye L.S., Bridges T.S., Ringelberg D.B.,
2001. Toxicity of sediment-associated nitroaromatic and cyclonitramine
compounds to benthic invertebrates. Env. Toxl. Chem., 20 (8): 1762-1771.
(2)-Lang P.Z., Wang Y., Chen D.B., Wang N., Zhao X.M., Ding Y.Z.,
1997. Bioconcentration, elimination and metabolism of 2,4-dinitrotoluene
in carps (Cyprinus carpioL.).Chemosphere, 35: 1799.
(3)-Burke M.D. and Mayer R.T., 1974. Ethoxyresorufin: direct
?uorimetric assay of a microsomal-O-dealkylation which is preferentially
inducible by 3-methylcholantrene. Drug Met Disp, 2: 583-588.
(4)-Ellman G.L., Courtney K.D., Andreas V.J.R., Featherstone R.M.,
1961. A new and rapid colorimetric determination of Acetylcholinesterase
activity. Biochem. Pharm., 7: 82-88.
(5)-Bradford M.M., 1976. A rapid and sensitive method for the
quantitation of microgram quantities of protein utilizing the principle of
protein-dye-binding. Anal. Biochem., 72, 248-254.
(6)-Smock L.A., Stonuburner D.L., Clark J.R., 1976. The toxic effects of
trinitrotoluene (TNT) and its primary degradation products on two species
of algae and the fathead minnow. Water Research, 10: 537-543.
(7)-Zitting A., Szumanska G., Nickels J., Savolainen H., 1982. Acute
toxic effects of trinitrotoluene on rat brain, liver and kidney: role of radical
production. Arch. Toxicol., 51: 53-64.
(8)-Leung K.H., Yao M., Stearns R., Chiu S.-H.L., 1995. Mechanism of
bioactivation and covalent binding of 2,4,6-trinitrotoluene. Chem. Biol.
Inter., 97: 37-51.
(9)-Johnson M.S., Vodela J.K., Reddy G., Holladay S.D., 2000. Fate and
the biochemical effects of 2,4,6-trinitrotoluene exposure to tiger
salamanders (Ambistoma tigrinum). Ecotox. Env. Saf., 46: 186-191.