SHRINKAGE EFFECTS ON SARDINE LARVAE (SARDINA PILCHARDUS)
CONSERVED BY ETHANOL AND LIQUID NITROGEN
A. García*, D. Cortés, L. Quintanilla and T. Ramírez
Instituto Español de Oceanografía, Centro Oceanográfico de Málaga, Fuengirola, Málaga, Spain - * agarcia@ma.ieo.es
Abstract
Sardine larval shrinkage observed under different conservation agents, liquid nitrogen and ethanol, is assessed. The degree of shrinkage
was affected by the type of conserving agent. While shrinkage observed in ethanol was independent of size, liquid nitrogen conserved
specimens were size dependent. Highest shrinkage occurred in ethanol. Care is recommended in measurements, because manipulation of
larvae can affect enlargement of body size.
Keywords: shrinkage, sardine, ethanol, liquid nitrogen
Rapp. Comm. int. Mer Médit., 37,2004
360
Introduction
Accurate estimates of larval length are essential in studies on the
early life histories of fish. Measurements of larval length are used in
order to estimate age, growth and nutritional condition.
Shrinkage of larvae, during fixation, may be a source of error,
necessitating the use of adjustments to convert from preserved to fresh
measurements. The degree of shrinkage may vary and depend on the
type of conservation agent (1; 2; 3), species preserved (3), and larval
size and age (2; 4).
Use of ethanol is recommended for the preservation of larvae for
age estimation from daily rings in otoliths (5), whereas, for age
estimation and biochemical analysis, freezing by liquid nitrogen is
recommended (6).
Material and methods
Sardine larvae were collected by means of a 1 m Bongo net (1mm
mesh) towed repeatedly at surface during 7-10 minutes at nightime.
Sardine larvae were sorted and standard length (SL) measured by an
image analysis system. After measurement, each larva was
individually conserved in an eppendorf using three conservation
methods: (1) stored in liquid nitrogen (LN); (2) 96% ethanol (OH),
and (3) in LN and sea-water (LN+SW). The number of larvae
analysed for each conservation agent were: (1) LN-conserved: 120
larvae of sizes 9.1-23.8 mm (8% average shrinkage); (2) OH-
conserved: 150 larvae of sizes 8.3-24.5 mm (9% average shrinkage);
and (3) LN+SW-conserved: 120 larvae of sizes 9.8-34.2 mm (6%
average shrinkage).
The conserved larvae were measured after 45 days. Those
conserved in LN were defrosted prior to measurement. To avoid bias,
as on board, the same measuring device and person did the
measurements. To test the effect of larval weight on shrinkage, those
conserved in LN were wet weighed, after SL measurement. To assess
the effect of manipulation on larval size, the conserved larvae LN +
SW were measured twice; the first measurement without
manipulation by simply defrosting the ice pellet in a Petri dish, while
the second measurement was carried out after transferring the larvae
to a slide by means of a paintbrush.
Results and discussion
The results of t-test for dependent samples show that all the
conservation agents used have a shrinkage effect on sardine larvae
(p<0.001). Maximum shrinkage was observed in ethanol-preserved
larvae. Linear relationships of conserved size versus fresh size showed
that shrinkage is size-dependent in LN, while ethanol-conserved
larvae were independent of size. The linear regressions of conserved
SL on fresh SL for each conservation method are:
1) LN SL(fresh)= 1.11*SL(conserved)-0.41 (R
2
= 0.94, n=120)
2) OH SL(fresh)= 0.96*SL(conserved)+1.94 (R
2
= 0.94, n=150)
3) LN+SW SL(fresh)= 0.99*SL(conserved)+0.86 (R
2
= 0.94, n=120)
To test the effect of conservation method and shrinkage, a two-way
ANOVA was carried out on 5 previously defined size classes (<10, 10-
13, 16-19, >19 mm). The results showed that all conservation methods
do not cause an equal shrinkage effect, the degree of shrinkage is not
the same for all size classes and there is an effect of the conservation
method used and the size classes on shrinkage (p<0.001). A post-hoc
comparison of means (Tukey HSD test) was subsequently done to
verify the results of the two-way ANOVA.
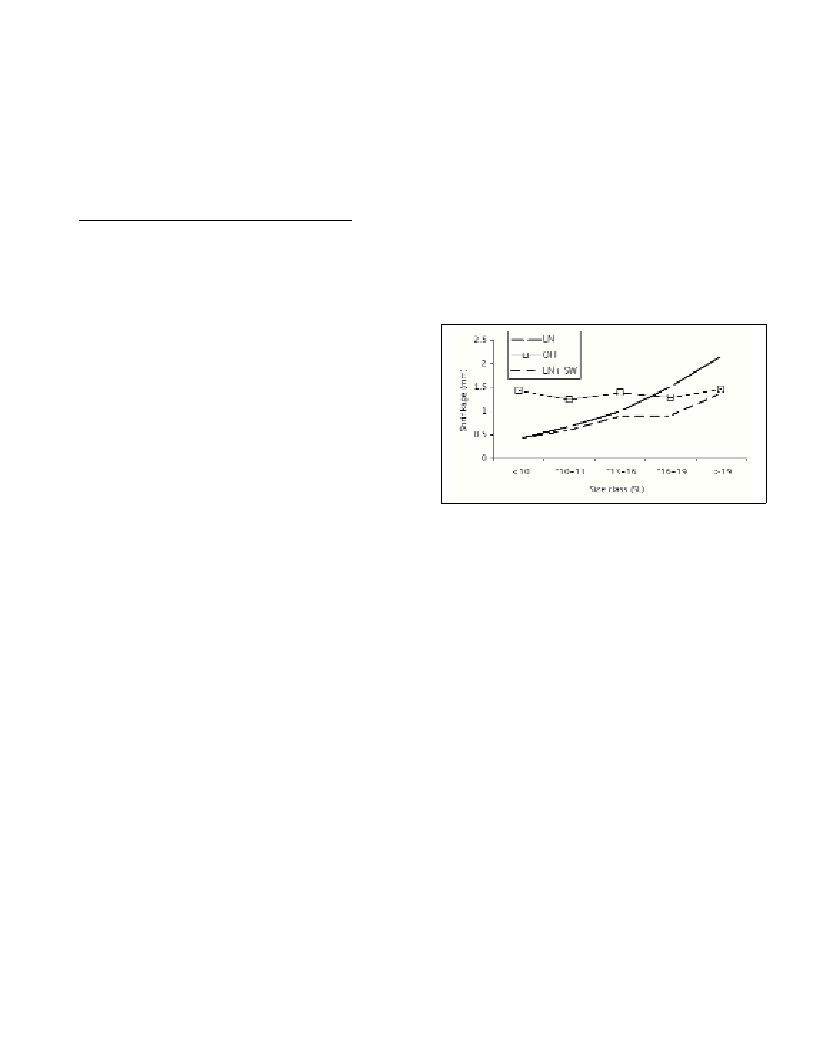
The results showed that mean shrinkage was significantly
(p<0.001) affected by size class in LN-preserved larvae, causing a
shrinkage increase with larval size, while those larvae conserved in
LN+sea-water, mean shrinkage was not significantly affected by size
class (p>0.05). For larvae conserved in 96% alcohol, mean shrinkage
showed a similar degree of shrinkage in all size classes (p>0.999),
therefore size-independent (Fig. 1).
Fig. 1. Mean shrinkage of sardine larvae by conservation agent and size
class.
To assess the effect of weight on shrinkage, an ANOVA was applied
on the weighed LN conserved larvae. The results indicated that weight
significantly (p<0.001) affects shrinkage, increasing with weight.
Lastly, to test the effect of manipulation to measure LN-conserved
larvae, a t-test was applied to compare measurements of non-
manipulated and manipulated larvae. The results showed that
manipulation significantly (p<0.001) affects size causing body size
enlargement.
It is important in larval studies to have accurate measurements at
live length. This study contributes to assess the effect of conservation
methods, on larval size and weight, as well as, the effect of
manipulation on the enlargement of body size.
References
1-Theilacker, G.H., 1980. Changes in body measurements of larval
northern anchovy, Engraulis mordax, and other fishes due to handling and
preservation. Fish. Bull.,78(3), 685-692.
2-Hjoerleifsson, E. and Klein-MacPhee, G., 1992. Estimation of live
standard length of winter ?ounder Pleuronectes americanuslarvae from
formalin-preserved, ethanol-preserved and frozen specimens. Mar. Ecol.
Prog. Ser., 82(1): 13-19.
3-Fey, D.P., 1999. Effects of preservation technique on length of larval
fish: Methods of correcting estimates and their implication for studying
growth rates. Bull. Sea Fish. Inst. Gdynia. 155: 47-51.
4-Hay, D.E., 1982. Fixation shrinkage of herring larvae: Effects of
salinity, formalin concentration, and other factors. Can. J. Fish. Aquat.
Sci., (39)8: 1138-1143.
5-Brothers, E.B., 1987. Methodological approaches to the examination
of otoliths in aging studies. Pp. 319-330. In: Summerfelt, RC; Hall, GE
(eds.) Age and growth in fish. Int. Symp. on Age and Growth in Fish, Des
Moines, IA (USA), 9 Jun 1985.
6-Buckley, L.J., and Bulow, F.J., 1987. Techniques for the estimation of
RNA, DNA, and protein in fish.Pp. 345-354. In: Summerfelt, RC; Hall,
GE (eds.) Age and growth in fish. Int. Symp. on Age and Growth in Fish,
Des Moines, IA (USA), 9 Jun 1985.