CHARACTERISTICS OF SUMMER GENERATION OF ADRIATIC MYSID HEMIMYSIS LAMORNAE
(COUCH, 1856) FROM THE AQUARIUM POPULATION,
EVALUATION FOR AQUACULTURE APPLICATION
Nikša Glavic*, Pero Tutman, Valter Kožul and Boško Skaramuca
IOR, Split, Laboratory for Ecology and Aquaculture, Dubrovnik, Croatia - * galvic@mailcity.com
Abstract
A population of Marine mysid Hemimysis lamornaefrom aquarium pools was statisticaly analysed, and was found to consist of 41% males
(TL 4,44668±0,489 mm), 28% females (TL 4,5727±0,5425 mm) and 31% juvenile individuals (TL 2,2103±0,7364 mm). Average egg
count were 4,166±6,06 eggs/female. Larger females carried more eggs and young than smaller females.
Keywords: Mysidacea, Hemimysis, population, fecundity, aquaculture
Rapp. Comm. int. Mer Médit., 37,2004
366
Introduction
New live food sources for aquaculture are sought for every day (1.
2), which can have a great in?uence for development of aquaculture
of several, mainly invertebrate species. Aside from Brachionus
plicatilis and Artemia salina, several mysid species are evaluated and
used as live food in larval production of marine cephalopods (3. 4),
and other species are being evaluated as potential candidates for
aquaculture use (5. 6). These results represent preliminary data on the
potential of Hemimysis lamornaeas a valuable live food organism.
Materials and methods
The samples of Hemimysis lamornaepopulations were collected
from the Dubrovnik aquarium concrete pools during October and
November, 2002, using a circular frame plankton net (500 µm mesh
size) towed through the mysid cloud. The animals were preserved in
5% buffered seawater formaldehide prior to measurements. The
specimens were measured under binocular microscope utilizing a
ocular micrometer with a printer. Total length (TL) was measured as
the distance between the tip of rostrum, between the eyestalks and the
posterior end of the telson, including the spine on it. Along with the
TL measure the sex composition and the egg-count/fecundity were
also recorded and analyzed at this point. The juveniles have not been
further analyzed and systhematized beyond determining the lack of
maturity characteristics such as the penises and pouch in the males
and females respectively.
Results
The length (TL)-frequency distribution on the cumulative
histogram (Fig.1) shows two diferent cohorts within this population,
one that consists of juvenile animals (2,210391±0,736434mm, N=93),
and other that consists of mature males (4,446668±0,489045, N=123)
and females (4,57278±0,542526, N=84). The distribution of TL in the
male and female group differed only by frequency, and otherwise
showed no statistical difference (ANOVA, p<0,05). The sex/maturity
composition of H. lamornaepopulation as percentages was
0,41:0,28:0,31 (males:females:juveniles). Brood size, i.e. the number
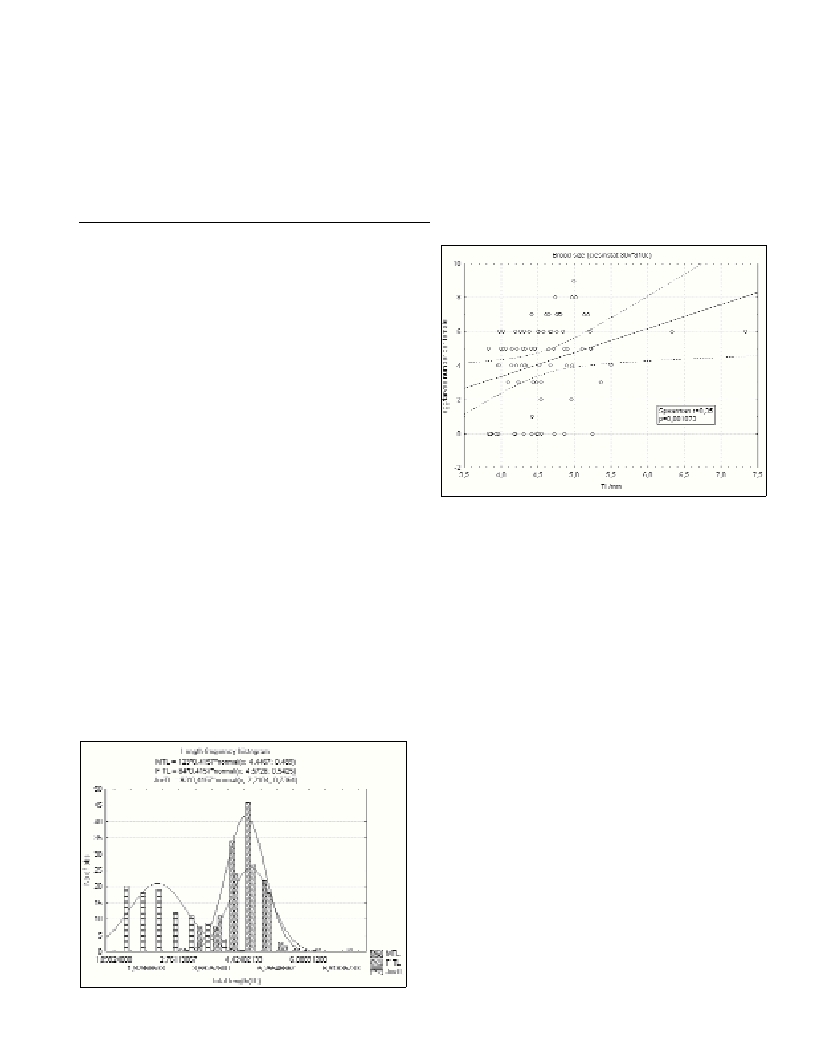
of larvae in the marsupium showed a positive correlation with total
length of females (TL) (Fig. 2), which indicates that larger females
produced larger broods.
Fig. 1. Length-frequency distribution of H. lamornaepopulation.
Fig. 2. Female TL/brood size regression plot.
Discussion
Some basic data are given on the summer population of marine
mysid Hemimysis lamornae. Length-frequency distribution within the
whole group of animals divided by sex and maturity criteria showed
bimodal distribution, with two groups, one of young animals, and the
other of adult males and females. The animals reached maturity at
approximately 3,0-3,5 mm (Fig. 1).
The results of the brood size analysis corroborate the hypothesis on
positive correlation with the female size (Fig. 2) (7), which is correct
for our single stage sample, but changes with different season (8), and
remains to be determined for H. lamornae by sampling throughout the
year.
References
1-DeRusha, R., H., Forsythe, J., W., Dimarco F., P. and Hanlon, R., T.,
1989. Alternative diets for maintaining and rearing cephalopods in
captivity. Laboratory and Animal Science, 39: 306-312.
2-Kuhn, A., H., Bengtson, D., A. and Simpson, K., L. 1991. Increased
reproductionby misids (Mysidopsis bahia) fed with enriched Artemia spp.
nauplii. American Fisheries Society Symposium, 9, 192-199.
3-Forsythe , J., W. and Hanlon, R., T., 1980. First rearing of Octopus
joubiniRobson, 1929 on mysidacean and caridean shrimps. Bulletin of the
American Malacological Union,42-45.
4-Lee, P., G., Turk, P., E., Yang, W., T. and hanlon, R., T., 1994.
Biological characterictics and biomedical applicatilns of the squid
Sepioteuthis lessonianacultured through multiple generations. Biomedical
Bulletin(Woods Hole), 186: 328-341.
5-Domingues, P., M., Turk, P., E., Andrade, J., P. and Lee, P., G., 1998.
pilot scale production of mysid shrimp in a static water system.
Aquaculture international, 6: 387-402.
6-Domingues, P., M., Fores, R., Turk, P., E., Lee, P., G. and Andrade, J.,
P., 2000. Mysid culture: lowering costs with alternative diets. Aquaculture
Research, 31: 719-728.
7-Mauchline, J., 1965. Breeding and fecundity of Praunus inermis
(Crustacea, Mysidacea). J. mar. biol. Ass. U. K., 45: 663-671.
8-Mauchline, J., 1971. The biology of Paramysis arenosa(Crustacea,
Mysidacea). J. mar. biol. Ass. U. K., 51: 339-345.