APPENDICULARIANS OF THE NORTHERN ADRIATIC SEA
Davor Lucic
1*
, Jakica Njire
1
, Robert Precali
2
, Dragica Fuks
2
and Jadranka Krstulovic
2
1
Institute of Oceanography and Fisheries, Laboratory Dubrovnik, Croatia
2
Center for Marine Research, Rudjer BoškovicInstitute, Rovinj, Croatia
Abstract
Appendicularians were collected monthly from 1999-2002 at three northern Adriatic stations with different productivity regimes. High
abundance, especially of juveniles, was found. Particularly large variations in Chl-a, picoplankton, and appendicularians may be
responsible for the failure to identify statistically significant correlations among these factors.
Keywords: juvenile/adult appendicularians, northern Adriatic
Rapp. Comm. int. Mer Médit., 37,2004
392
Intoduction
The ability of appendicularians to retain suspended particles down
to the sub-micron range (1) makes them an important step in the
microbial food web that links picoplankton with larval fish. The
present study focuses on the density and distribution of appendicu-
larians in the northern Adriatic, a productive ecosystem particularly
in?uenced by industrial and municipal discharge of the Po River (2).
Materials and methods
Samples were taken monthly (February 1999-August 2002) at three
stations between the Po River delta and Rovinj (Croatia): SJ101, near
the delta; SJ105, in the central part; ZI032, near Rovinj. Water was
collected with a 5-l Niskin bottle at 0.3, 5, 10, 20, and 30 m (near
bottom). Temperature was measured with a reversing thermometer
and salinity with a Yeo-Kal MkII salinometer. Epi?uorescence micro-
scopy was used to count picoplankton (DAPI-stained bacteria and
coccoid cyanobacteria). Chlorophyll a(Chl a) was analyzed ?uoro-
metrically. Juvenile appendicularians were sedimented for 72 h, until
the original volume (5 l) was reduced to 3 ml. Adults were collected
with vertical tows of a standard WP2 plankton net.
Results and discussion
Temperature (Table 1) ?uctuations were typical for a neritic area,
with stratification beginning as early as May and a sharp thermocline
forming by early summer. Salinity oscillations were more pronounced
in spring and fall.
Picoplankton occurred in particularly high numbers during spring
and summer at SJ101, and throughout the summer at others stations.
The highest Chl-awas found in spring and fall, while high abundance
of picoplankton was noted in summer and fall. There was a significant
horizontal gradient in picoplankton abundance and Chl-aconcen-
tration (Kendall’s coefficient of concordance; p<0.001; sequence of
abundance = SJ10>SJ105>ZI032). Significantly higher values were
noted in the surface layer (0.3 m and 10 m) at SJ101 and SJ105
(Mann-Whitney Test; p<0.001).
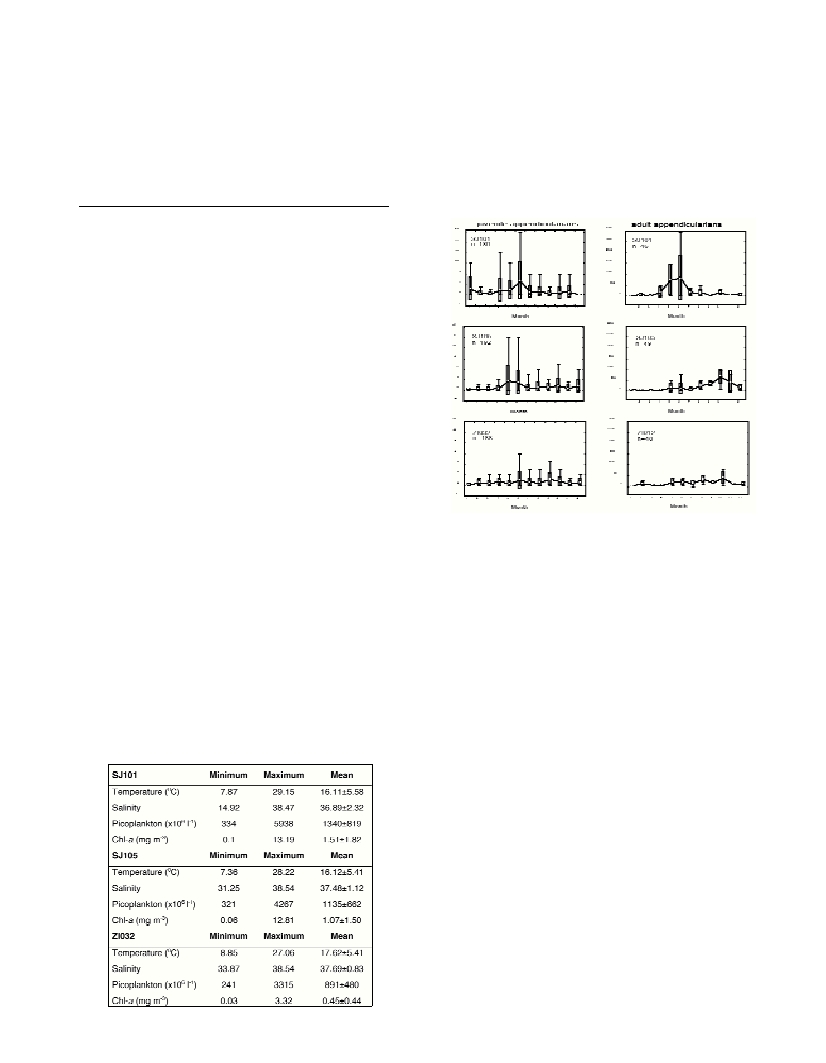
Juveniles were most numerous in spring (Fig. 1), with a maximum at
all stations in June: 24 ind.l
-1
at SJ101; 20 ind.l
-1
at SJ105; 12 ind.l
-1
.
Higher juvenile abundances were found in January at SJ101, during fall
at SJ105, and in summer at ZI032. No significant difference in
abundance was found between surface and bottom layers. Comparison
of the mean number of juveniles and adults showed a positive correla-
tion at SJ101 (n=46, r=56, p<0.001).
A pronounced maximum of adults, 2899 ind.m
-3
, was noted in June
at SJ101. Highest values at other stations were lower and occurred in
fall (Fig. 1). The most numerous species at SJ101, Oikopleura dioica,
made up 50% of total appendicularians. Other stations were
dominated by O. longicauda(50%). O. fusiformiswas the third most
important species. Regarding other species, peaks were found for
Fritillaria borealisin October 2000 (452 ind.m
-3
) and F.pellucidain
November 2001(632 ind.m
-3
) at SJ105; and for F. haplostomain
October 1999 at ZI032 (307 ind.m
-3
). Kowalewskia tenuiswas present
sporadically from May to July, and O. graciloidesin winter at ZI032.
Both in terms of quality and quantity, these samples were similar to
those found in earlier investigations (3).
No difference in the abundance of juveniles and adults was found
between stations. Appendicularian growth and abundance are mostly
affected by temperature and food availability (2, 4). Temperature and
salinity clearly in?uenced seasonal succession, especially at those
stations distant from the Po. Large variations both in picoplankton and
Chl a, as well as complex predator-prey relations along a trophic
gradient, might be responsible for the lack of correlations among these
factors and appendicularian abundance. Part of the variability also
might be owed to mucilage events that occurred during the research
period. High picoplankton and Chl-aobserved during this study
suggest appendicularians were not food-limited in the study area.
References
1-Gorsky G., Chrétiennot-Dinet M.J., Blanchot J., and Palazzoli I., 1999.
Picoplankton and nanoplankton aggregation by appendicularians: Fecal
pellet contents of Megalocercus huxleyiin the equatorial Pacific,
J.Geophysical Res., 104: 3381-3390.
2-Degobbis D., Precali R., Ivancic I., Smodlaka N., Fuks D., and Kveder
S., 2000. Long-term changes in the northern Adriatic ecosystem related to
anthropogenic eutrophication. Int. J. Environ. Pollut., 13: 495-553.
3-Skaramuca B., 1983. Quantitative and qualitative distribution of
appendicularians population in the open waters of the Adriatic Sea. Acta
Adriat., 24: 133-177.
4-Acuña J.L and Anadón R., 1992. Appendicularian assemblages in a
shelf area and their relationship with temperature. J. Plankton Res., 14:
1233-1250.
Table 1. Minimum, maximum, and mean hydrographic and biotic param-
eters in the northern Adriatic Sea during 1999-2002.
Fig. 1. Box plot of numerical abundance of appendicularians in the north-
ern Adriatic Sea during 1999-2002. Middle tiny squares and line indicate
means; boxes, standard deviations; whiskers, min-max values.