OVARIAN STRUCTURE AND ANNUAL REPRODUCTIVE CYCLE OF SCORPAENA PORCUS
Maria Sābat*, Maria Rosa Hernández, Marta Muņoz and Margarida Casadevall
Ārea de Zoologia, Departament de Cičncies Ambientals, Facultat de Cičncies, Universitat de Girona, Spain
* maria.sabat@udg.es, rosa.hernandez@udg.es, marta.munyoz@udg.es and margarida.casadevall@udg.es
Abstract
The ovarian structure, the seasonal histology of the ovary, and various indices related to reproduction of Scorpaena porcuswere analysed.
The ovary showed many characteristics that are not typical for oviparous fishes: central ovarian stroma, pedunculate oocytes, scarcity and
small size of cortical alveoli, thinness of the zona radiata, and a gelatinous matrix secreted during the maturation phase. The hepatic
reserves were basically used for the final process of maturation. Spawning takes place between June and August.
Keywords: Scorpaena porcus, ovarian structure, reproductive cycle
Rapp. Comm. int. Mer Médit., 37,2004
431
The black scorpionfish (Scorpaena porcusL. 1758) is one of the
most common species of the Scorpaenidae family. It is a sedentary
species, living mainly in rocky and sea-grasses bottoms, at depths of
up to 800 m (1). Although it is very abundant off the coasts of
Catalonia and of commercial interest, there is not much information
about its reproductive biology. The aim of the present work was to
study the annual reproductive cycle of female black scorpionfish, on
the basis of the ovarian structure, its histological changes, and various
indices related to reproduction. The ovaries were classified according
to the most developed type of oocyte (2).
The ovary of black scorpionfish shows a lot of peculiar characteris-
tics that are not usual in oviparous species. Firstly, the ovary is of the
cystovarian II-3 type (3), as it is surrounded by the ovarian wall and
has the muscular-connective rachis and the blood vessels in its centre.
Furthermore, the oocytes develop ovarian vascularized peduncles,
considered in viviparous species to be protuberances of the placentary
or pseudo-placentary connections (4). Finally, the cortical alveoli are
scarce and with small size, and the thickness of the zona radiata is
considerably less than that in other oviparous species. Both these
characteristics have also been associated with viviparity in fishes (5).
This special ovarian structure it is similar to that described for anoth-
er scorpionfish, Scorpaena notata(6).
The female reproductive cycle begun in September, when the entire
ovary is in the previtellogenesis stage. In April, oocyte in cortical alve-
oli stage appeared for the first time, and in May begun the vitellogenic
and maturation phase. From May to August, the internal epithelium of
the ovarian wall developed many cytoplasmic projections which,
together with the lamellar epithelium, secret a transparent and gelati-
nous ovarian ?uid.
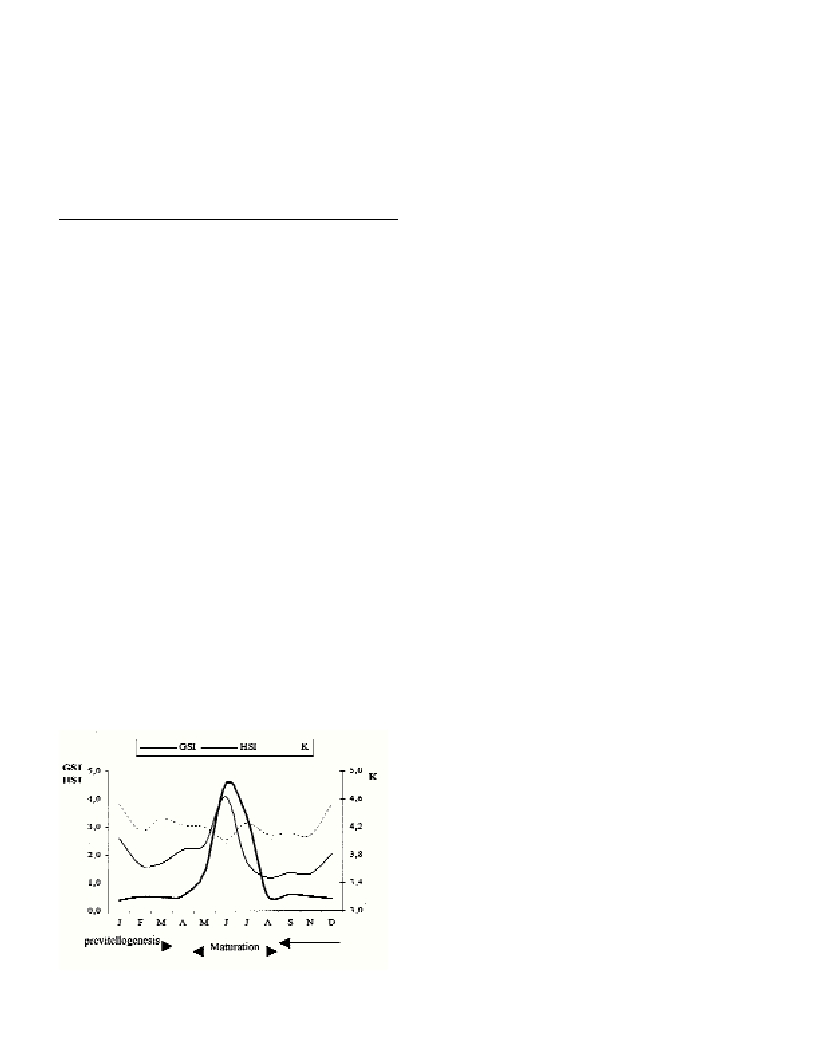
The annual development of gonadosomatic index (GSI = gonad
weight/evicerated weight x 100), hepatosomatic index (HIS = liver
weight/evicerated weight x 100) and condition factor (K = evicerated
weight/standard length x 100), is shown in figure 1. As is it shown in
this graphic, in the beginning of vitellogenesis the liver stored ener-
getic reserves, which will be used for the final process of maturation.
On the other hand, there were not any monthly significant differences
for the condition factor (K) (ANOVA, p = 0,550), although it has to be
pointed out the slightly decrease between June and July which is relat-
ed to the demand of energy for the vitellogenesis process (7). The
mean gonadosomatic index changed significantly throughout the year
(ANOVA, p < 0,001), showing a peak in the final maturation phase of
the ovary. Based on GSI and the presence of hydrated oocytes and
postovulatory follicles during June and July, spawning in black scor-
pionfish extends from June to August.
References
1-Whitehead P.J.P, Bauchot M.L., Hureau J.C., Nielsen J., Tortonese E.,
1986. Fishes of the North-eastern Atlantic and the Mediterranean.
UNESCO, Paris.
2-West G., 1990. Methods of assessing ovarian development in fishes: a
review. Aust. J. Mar. Freshwat. Res., 41: 199-222.
3-Takano K., 1989. Ovarian structure and gametogenesis. Pp. 3-34. In:
Takashima F. and Hanyu I. (ed.). Reproductive Biology of Fish and
Shellfish. Midori-Shobo, Tokyo.
4-Erickson D.L. and Pikitch, 1993. A histological description of
shortspine thornyhead, Sebastolobus alascanus, ovaries: structures
associated with the production of gelatinous egg masses. Environ. Biol.
Fish., 36: 273-282.
5-Takemura A., Takano K. and Takahashi H., 1987. Reproductive cycle
of a viviparous fish, the white-edged rockfish, Sebastes taczanowskii. Bull.
Fac. Fish. Hokkaido Univ., 38(2): 111-125.
6-Muņoz M., Casadevall M. and Bonet S., 2002. The ovarian
morphology of Scorpaenanotata shows an specialized mode of oviparity.
J. Fish Biol., 61: 877-887.
7-Santos R.S, Hawkins S.J. and Nash R.D.M., 1996. Reproductive
phenology of the Azorean rock pool blenny a fish with alternative mating
tactics. J. Fish Biol., 48: 842-858.
Fig.1. Annual development of gonadosomatic index (GSI), hepatoso-
matic index (HSI) and condition factor (K) related to the reproductive
cycle of black scorpionfish.