RECURRENT BLOOMS OF ALEXANDRIUM CATENELLA IN MEDITERRANEAN CONFINED WATERS
Magda Vila
1*
, Mercedes Masó
1
, Esther Garcés
1
, Nagore Sampedro
1
, Isabel Bravo
2
, Antonella Luglié
3
,
Kees van Lenning
1
, Silvia Anglés
1
, Blanca Puig
1
and Jordi Camp
1
1
Institut Ciències del Mar, Barcelona, Spain - *magda@icm.csic.es
2
Instituto Español de Oceanografía, Vigo, Spain
3
Dipartamento Botanica ed Ecologia Vegetale, Sassari, Italy
Abstract
Paralytic Shellfish Poisoning (PSP) events related to phytoplankton blooms have increased worldwide. In the Mediterranean Sea, species
belonging to the genus Alexandriumare chie?y associated with PSP events, and A. catenellais one of its most toxic. Before A. catenella
had been detected in the Mediterranean Sea, that species was related to productive, cold upwelling regimes. However, in the Mediterranean
Sea, A. catenellablooms are often localised phenomena that occur in enriched and confined coastal waters (harbours, bays). An intensive
study was carried out during a huge bloom of this species in the Tarragona harbour in 2002.
Keywords: Harmful Algal Blooms, Alexandrium catenella, harbours, Paralytic shellfish poisoning, dino?agellate
Rapp. Comm. int. Mer Médit., 37,2004
455
The most widespread Alexandriumthat can be detected in the
Mediterranean Sea is A. minutum. This species was first described in
the Alexandria harbour (1), but it was thirty years later when that
species was reported to be linked to toxicity in Mediterranean waters
(2). Since then, numerous PSP outbreaks caused by A. minutumhave
been detected in the Mediterranean Sea. A. minutumwas the unique
Alexandriumspecies related to toxic events in the Mediterranean Sea
for several years. It is important to mention that A. minutumblooms
have always been described as localised phenomena related to
harbours and lagoons (see 3 for revision). In the summer of 1998 the
first widespread PSP event in the Mediterranean Sea occurred along
the Catalan coast (100 Km affected) and it was caused by A. catenella.
In the summer of 1999 a similar event took place again (4).
Along the southern Catalan Coast, A. catenellashowed a clear
seasonal pattern, being detected in several harbours from May to
October. In 2002, a huge bloom of that species occurred in the
Tarragona harbour (max. 9x10
6
cells·l
-1
, end September) at 22°C,
producing a reddish-brown discoloration of the waters. The Tarragona
harbour is one of the biggest harbours in the Mediterranean (4,5 km
long; 600m to 2Km wide) with considerable commercial and fishing
activities. This harbour receives freshwater in?ows from the Francolí
river. The river discharge is situated near the mouth harbour (inside
side). A.catenellablooms have taken place there yearly, at least since
1998.
In 2002, A. catenellamoderated cell densities (<10
4
cells·l
-1
) were
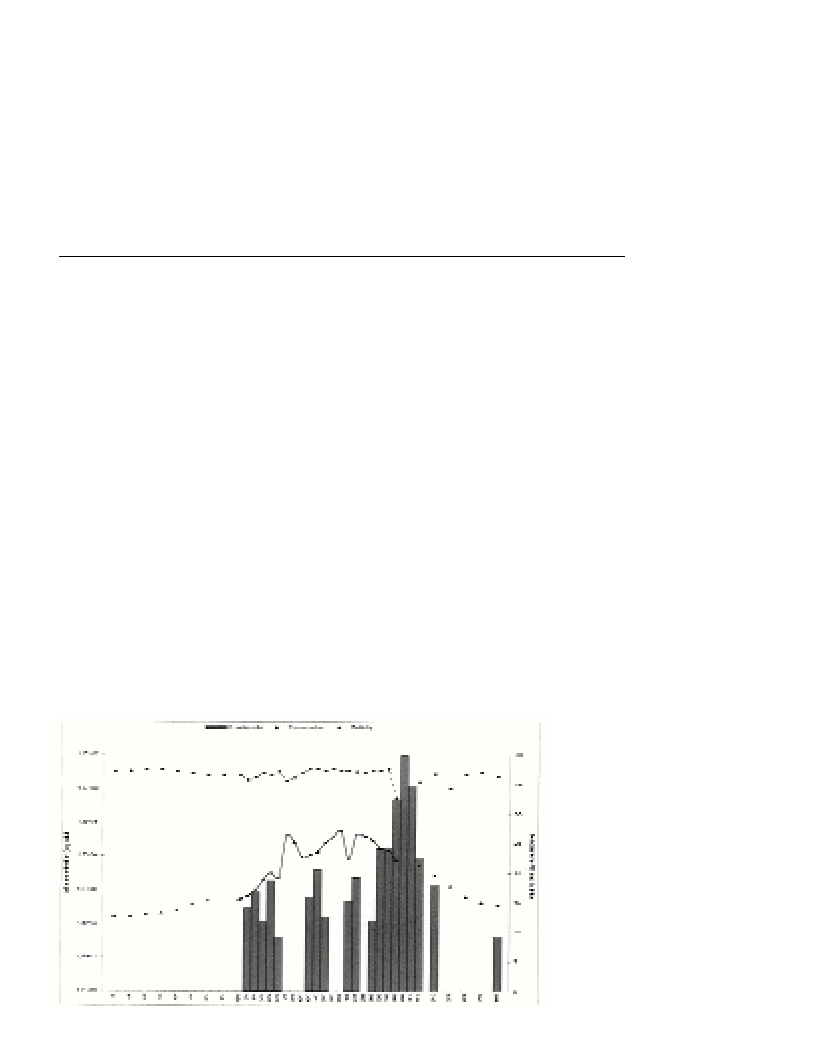
detected in the Tarragona harbour from mid-May, but it started
blooming at the end of September (Fig. 1). It coincided with a salinity
decrease (32) and with a high nutrient load (nitrate, ammonium,
silicate and orthophosphate peaks of 40, 18, 37 and 1.8
µ
M,
respectively). The nearly monospecific outbreak of A. catenellain
Tarragona was intensively studied according to space and time. The
bloom was followed every 3-4 days at 3 stations. In addition, a cruise
was carried out when the organism rose to 10
6
cells·l
-1
. The cruise
consisted in a transect (6 stations from the most confined parts of the
harbour to the mouth) which was repeated three times during that day:
in the morning (9:00-10:30h, GMT), at midday (13:30-15:15) and at
noon (16:30-18:00). CTD casts were performed at each station and
samples were taken every metre from the surface to a depth of 10m.
A. catenella (total cell number and cells per chain), chlorophyll and
total inorganic nutrients were analysed. Pigments and PSP toxins
were analysed by HPLC at surface level during the midday transect.
Sediment samples were taken by scuba diver 8 months later (April
2003) to study the potential seedbeds.
The horizontal spatial variability of the organism was linked to the
water confinement. The highest concentrations of A. catenella were
detected in the inner part of the harbour (around 6·10
6
cells·l
-1
) and
diminished in the mouth (10
4
-10
5
cells·l
-1
). That pattern remained the
same the whole day. The vertical distribution was characterised by a
thick layer of 6m that contained the bulk of the population. A clear
vertical pattern associated to temporal variability was not observed,
except for the inner stations. In the three cruises, the average number
of single cells was high (about 75%). The relative number of chains
increased according to depth and proximity to the mouth of the
harbour. Results of the sediment sampling could explain the
recurrence blooms of A. catenella (max. conc. 3480 cysts·cm
-3
of wet
surface sediment).
Results indicate that the A. catenella blooms in the Mediterranean
Sea are small-scale phenomena, related to confined waters and
originated by autochthonous seedbeds. Nevertheless, exportation of
cells to open waters could cause widespread PSP events. For instance,
during the same year an A. catenellabloom occurred in the Olbia
harbour (Sardinia, Italy). Unexpectedly, at the end of the bloom, the
highest densities were detected out of the harbour area (max. 4·10
4
cells·l
-1
). This distribution could probably be due to cell exportation
and accumulation. Comparative studies between the two affected sites
(Tarragona and Olbia harbour) are carried out.
This study was performed within the frame of the EU project
STRATEGY (EVK3-CT-2001-00046).
References
1-Halim Y., 1960. Alexandrium
minutum, nov. gen. nov. sp. dino?agellé
provocant des eaux rouges. Vie Milieu,
11: 102-105.
2-Delgado M., Estrada M., Camp J.,
Fernández J.V., Santmartí M., and Lletí
C., 1990. Development of a toxic
Alexandrium minutumHalim (Dinophy-
ceae) bloom in the harbour of Sant Carles
de la Rápita (Ebro Delta, northwestern
Mediterranean). Scien. Mar.54(1): 1-7.
3-Vila M., Camp J., Garcés E., Masó M.,
and Delgado M., 2001. High resolution
spatio-temporal detection of potentially
harmful dino?agellates in confined waters
of the NW Mediterranean. J. Plankton
Res. 23(5): 497-514.
4-Vila M., Garcés E., Masó M., and
Camp J., 2001. Is the distribution of the
toxic dino?agellate Alexandrium cate-
nellaexpanding along the NW
Mediterranean coast? Mar. Ecol. Prog.
Ser.222: 73-83.