THE PARTICULATE ß-DIMETHYLSULPHONIOPROPIONATE (DMSP) LEVELS IN RELATION
TO PHYTOPLANKTON SPECIES DURING A SPRING BLOOM IN TOULON BAY (FRANCE)
Natacha Jean
1
, Jean-Louis Jamet
2*
, Gérard Boge
2
and Dominique Jamet
2
1
CNAM / Intechmer E.A 3202 “Environnements Marins Naturels et Contrôlés”, Cherbourg France
2
Université de Toulon et du Var, Equipe de Biologie des Milieux Aquatiques, EBMA, Laboratoire des Processus de Transferts et
d’Echanges En Environnement, EA, La garde, France - * jamet@univ-tln.fr, boge@univ-tln.fr, d.jamet@univ-tln.fr
Abstract
This work investigated the origin of particulate DMSP in a Mediterranean ecosystem perturbed by anthropogenic inputs (Toulon bay,
France). We studied the contribution of phytoplankton species to DMSP levels. Dino?agellates were always predominant in comparison
to Bacillariophyceae and peaked in March-April. The intracellular concentrations of DMSP revealed that Dino?agellates contained about
five times more DMSP than Bacillariophyceae. Alexandrium minutumproduced up to 56% of the DMSP pool. We suggest that the
production of the nitrogenous toxin by Alexandrium minutummay explains its high levels of DMSP synthesis.
Keywords : DMSP; Alexandrium minutum; eutrophication; coastal ecosystem; mediterranean sea
Rapp. Comm. int. Mer Médit., 37,2004
527
Dimethylsulphide (DMS) is the most abundant form of volatile
sulphur in the ocean and is produced by the enzymatic cleavage of ß-
dimethylsulphoniopropionate (DMSP), which is abundant in
phytoplankton (1). It is accepted that DMSP is an osmolyte and a
cryoprotectant for marine algae (2).
We have studied particulate DMSP in Toulon Bay for the size class
5-90 µm to show the contribution of phytoplankton species to DMSP
levels in this perturbed and eutrophic littoral marine ecosystem.
Protein concentrations were used to determine the biomass. To
compare the phytoplankton activity with DMSP synthesis, the
DMSP/protein ratio was calculated.
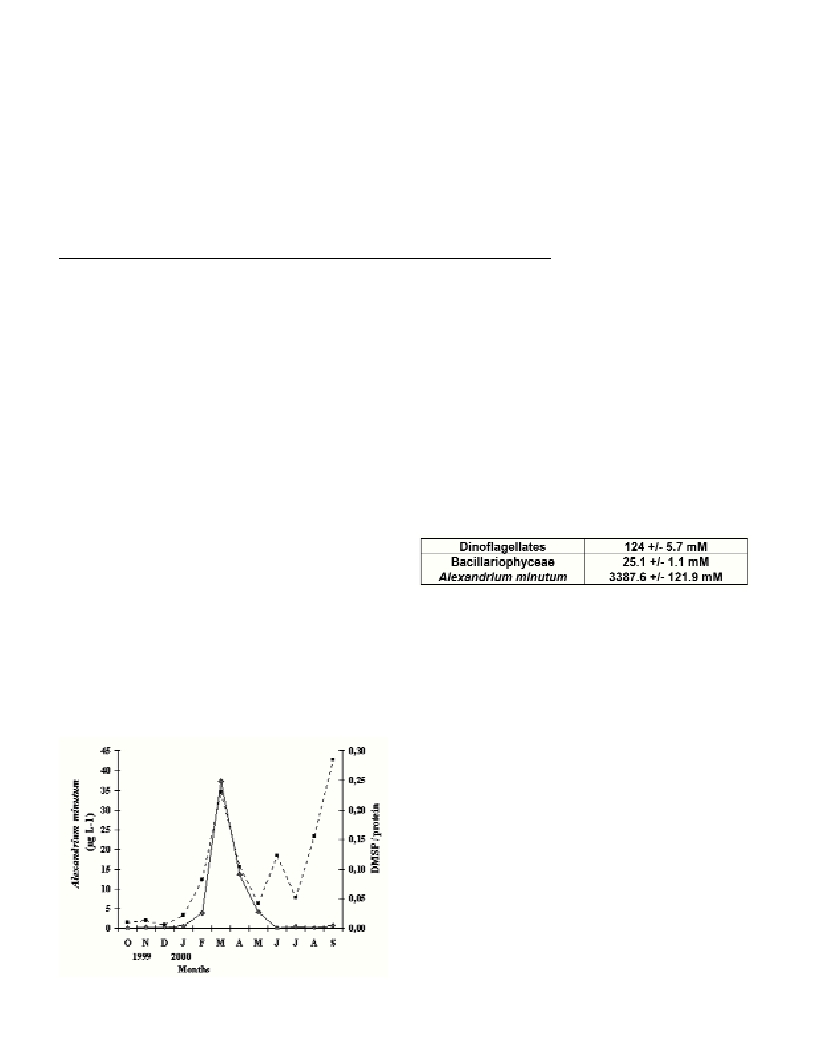
The temporal evolution showed three peaks (March, June and
September, Fig. 1). The March peak corresponded to the highest total
level of DMSP synthesis (0.58 nanomoles DMSP.µg-1). The 5–90 µm
size class was principally composed of algal cells belonging to the
Dino?agellates or to the Bacillariophyceae. Dino?agellate biomass
and abundance peaked in March-April, whereas Bacillariophyceae
biomass and abundance peaked in October-November. No
relationship (p > 0.1, Spearman test) was found between Bacillario-
phyceae biomass and the DMSP concentration, whereas a significant
correlation was observed between Dino?agellate biomass and DMSP
concentration (r = 0.699; p = 0.011). We have separated Bacilla-
riophyceae and Dino?agellates out of seawater to determine their
respective contributions to DMSP production. Comparison of the
intracellular concentrations of DMSP in the two samples revealed that
Dinoflagellates contained about five times more DMSP than
Bacillariophyceae (Table 1). These results highlight the importance of
Dino?agellates and the minor contribution of Bacillariophyceae in
DMSP production. We had also identify the species implicated in
DMSP synthesis. The peaks of biomass were consistent with peak of
DMSP above all for Alexandrium minutum(Fig. 1). Five
monospecific samples were prepared and analysed for DMSP
contents. The intracellular content per unit of biovolume was highest
in A. minutum(Table 1).
Our results suggest that the semi-enclosed configuration of Toulon
Bay and its exposure to high levels of human activity could lead to
stronger productivity involving high concentrations of DMSP. This
hypothesis is in accordance with (3). In addition, it is generally
accepted that Prymnesiophytes and Dino?agellates produce more
DMSP than Bacillariophyceae. (4) measured similar values in
Dino?agellates (355 to 972 mM). A. minutumproduce toxins such as
PSP (paralytic shellfish poison) and DSP (diarrheic shellfish poison)
(5) and grows better in nitrogen-rich ecosystems. This specific
nitrogen requirement could be due to the production of nitrogenous
precursor of the PSP, called saxitoxin (STX) (6). In the
osmoregulation in algal cells, two compounds could be produced
(DMSP or Glycine betaine, GBT). The production of GBT require
high nitrogen levels. In Toulon Bay, high DMSP levels have been
found in A. minutumsuggesting the preferential synthesis of DMSP
rather than GBT. This suggests that the nitrogen requirement of A.
minutumwas not totally fulfilled in spite of the high nitrate levels.
Table 1. Intracellular concentrations of DMSP in phytoplanktonic algae.
References
1-AckmanR.G., TocherC.S., and Mac Lachlan J.,1966. Occurrence of
dimethyl-ß-propiothetin in marine phytoplankton. J. Fish. Res. Bd.
Canada,23: 357-364.
2-KarstenU., WienckeC., and KirstG.O., 1992. Dimethylsulfoniopro-
pionate (DMSP) accumulation in green macroalgae from polar to
temperate regions: interactive effects of light versussalinity and light
versus temperature. Polar Biol., 12: 603-607.
3-NikiT., KunugiM., KohataK., OtsukiA., 1997. Annual monitoring of
DMS-producing bacteria in Tokyo Bay, Japan, in relation to DMSP. Mar.
Ecol. Progr. Ser., 156: 17-24.
4-BelvisoS., ChristakiU., VidussiF., MartyJ.-C., VilaM., and Delgado
M., 2000. Diel variations of the DMSP-to-chlorophyll ratio in
Northwestern Mediterranean surface waters. J. Mar. Syst., 25: 119-128.
5-LassusP., ArzulG., ErardE., GentienP., and Marcaillou C., 1995.
Phytoplankton time – series data of the French phytoplankton monitoring
network: toxic and dominant species. In: Belin C., Bellaeff B., Raffin B.,
Ibanez F., and M. Rabla M. (eds.), Harmful Marine Algal Blooms,
Technique et Documentation, Lavoisier, Intercept Ltd.
6-PremazziG., and VolterraL., 1993. Microphyte toxins. Joint Research
Center Edition, CE, Ispra, 336 p.
Fig. 1. Relationships between the DMSP / protein ratio (black square)
and the Alexandrium minutum biomass (grey diamond).