ECOLOGICAL STRUCTURE AND DYNAMICS OF THE SEAGRASS CYMODOCEA NODOSA
IN MONTAZAH BAY OFF ALEXANDRIA, EGYPT
S. H. Shabaka
1*
, H. M Mostafa
2
H. Mitwally
2
, Y. Halim
2
1
National Institute of Oceanography and Fisheries, Alexandria, Egypt
2
Department of Oceanography, Faculty of Science, University of Alexandria, Egypt - youssefhalim@hotmail.com
Abstract
Cymodocea nodosawas sampled from different sites located within a seagrass bed in Montazah Bay, Alexandria, Egypt. Samples were
collected at bimonthly during the period from February 2002 to December 2002. Physico-chemical parameters were measured in
conjunction with seagrass phenological parameters. Generally, all phenological parameters except rhizome-root biomass showed
maximum values in late spring (June), and minimum values during winter. Rhizome-root biomass, showed an opposite trend. It was
concluded that although light and temperature are the major factors controlling seasonality of C. nodosa growth, during summer the growth
is limited by other factors, mainly self-shading and nutrient limitation. Five environmental factors were identified as important in
controlling biomass and abundance of C. nodosa. These include temperature, salinity, light, water and sediment nutrient concentrations.
Qualitative determination of associated epiphytes was also performed.
Key words: Seagrasses; Cymodocea nodosa; Montazah; Alexandria; Egypt
Rapp. Comm. int. Mer Médit., 37,2004
550
The presence of the two species of seagrasses Posidonia oceanica
and Cymodocea nodosaalong the Egyptian Mediterranean waters is
largely documented (1, 2,3, 4). Along Alexandria coastal waters,
many beds have been badly damaged and seagrasses are reduced to
scattered patches in inshore semi-closed bays. In front of Alexandria,
seagrass beds are exposed to untreated wastewater pollution and
turbidity. Growth of C. nodosais continuous throughout the year with
a unimodal cycle. Its foliage started to increase toward spring and
became particularly dense in late spring (June), with maximum-
recorded shoot density (131shootsm
-2
±44) and leaf density (368
leafm
-2
±473). These values decreased towards summer. Minimum
shoot and leaf densities were recorded during winter (52 shootm
-2
±8,
113 leafm
-2
±13). Leaf area index, leaf length, epiphytic area,
photosynthetic area and leaf biomass showed the same cyclic pattern
as shoot and leaf densities. Rhizome-root biomass showed an opposite
cyclic pattern to the other phenological parameters, where maximum
values were recorded during winter (23.4gm dwm
-2
±6), and
minimum values recorded June (4.7gm dwm
-2
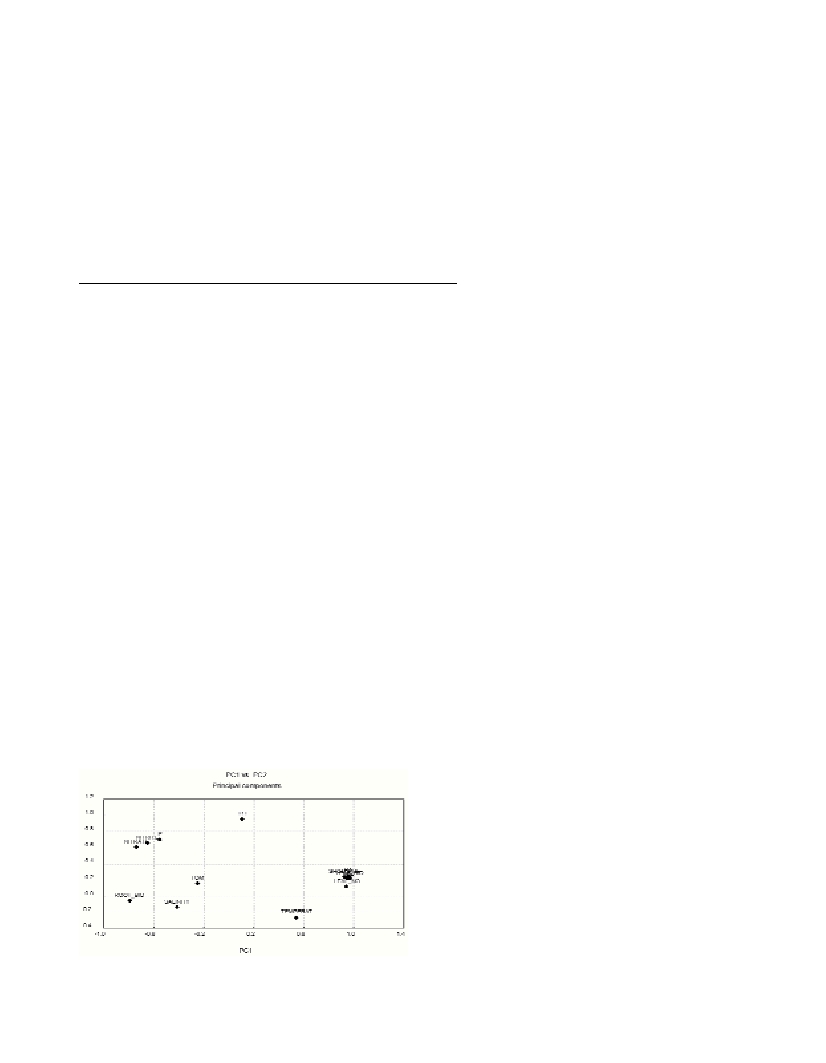
±2). Principal
component analysis was used for “C. nodosa phenological-
Physicochemical parameters relationship”. Plotting PC1 against PC2
(Fig.1) revealed that phenological parameters of the foliar system
had positive correlations with temperature and PH, and negative
correlations with dissolved nutrients and salinity and insignificant
correlation with total sediment organic matter (TOM). Root-rhizome
biomass showed completely opposite correlations to those of the
foliar system. Seasonal variation of the foliar system of C. nodosa
could probably be related to changes in temperature and light
availability. Changes in temperature over the year seem to play an
important role in the reproduction cycle of C. nodosa, which in?uence
the leaf growth and production (5). In the meadow under study, a male
?ower and seeds were recorded at the end of April. It seems to be that
seeds were dormant, buried in the sediment until germination started
in April, coinciding with the rise in water temperature. It was
observed that the potential production set by the incoming irradiance
and water temperature was not met during summer. This deviation
may be attributed to the following reasons: a)Increased epiphytic
growth on plant leaves in late spring. b)Self-shading by the plants,
where maximum leaf length was recorded during late spring. c)
Higher turbidity observed in the bay during summer d)Nutrient
limitation of summer growth, where minimum dissolved nutrient
concentrations was recorded during late spring. This may be attributed
to the active consumption of the seagrass to the dissolved nutrients.
The reduction of salinity due to intrusion of fresh water that may carry
high concentrations of dissolved nutrients caused the initiation of the
foliar system growth in late winter. The opposite correlation between
the underground biomass and foliar system biomass may be attributed
to the dependence of the rhizome and roots on the extensive foliar
system biomass during their growing season in absorption of the
nutrients from the surrounding water. After the collapse of the foliar
system that occurred in the summer season, rhizome and root system
started to increase in biomass to compensate the reduction of dis-
solved nutrients in seawater by absorption of the nutrients from the se-
diments. The sediment is the main source for phosphorus in carbonate
sediment seagrasses, the acquisition of phosphorus by both seagrasses
P. oceanica and C. nodosamight be limited by sparse supply in water
column and their ability of speeding up the uptake of phosphorus from
the sediments (6). In Montazah Bay, turbidity caused by water sports
and seagrass damaging are a threat to seagrass meadows. Despite
these destructive factors, C. nodosais a eurybiontic species tolerates
considerable ?uctuations in environmental variables. This may
explain the dominance of C. nodosaover the P. oceanicawhen the
conditions are unfavorable for the stenobiontic P. oceanica(4).
Cymodocea nodosa epiphytic associations:
Floral epiphytes: Blue green algae: Anacystis aeruginosa,
Oscillatoria lutea.Red algae: Audouinella thuretii, A. virgatula,
Bangia atropurpurea, Chroodactylon ornatum, Erythrocladia carnea,
Hydrolithon farinosum, Melobesia membranacea, Pneophyllum
fragile kuetzing, Porphyrostromium ciliare, Sahlingia subintegra,
Stylonema aslidii, S. cornu-cervi. Brown algae: Giraudia
sphacelarioides, Myrionema orbiculare. Green algae: Cladophora
socialis, Entocladia ?ustrae, Ulvella len(Personal comm. Prof.
Giusppe Giaccone).
References
1-Steuer, A., 1935. The fishery grounds near Alexandria. I-Preliminary
report. In notes and memories, no. 8 Cairo.
2-Aleem, A.A., 1955. Structure and evolution of the seagrass
communities Posidoniaand Cymodoceain the southern Mediterranean.
Essays in the natural science in the honor of Capitan Allan Hancock.
Univers. Of S. Calif. press Los Angeles, Calif., pp. 279-298.
3-Mostafa, H. M., 1996. Preliminary observations of the seagrass
Cymodocea nodosa(Ucria) Asherson in the Mediterranean waters off Ale-
xandria, Egypt. Bull. Nat. Inst. Of Oceanogr. & Fish., A. R. E., (22): 19-28.
4-Den Hartog, C., 1970. The seagrasses of the world. North- Holland
publishing Co., Amsterdam, 275 p.
5-Buia, M. L. Mazzella, 1991. Reproductive phenology of the
Mediterranean seagrass Posidonia oceanica(L.) Delile, Cymodocea
nodosa(Ucria) Ashers., and Zostera notliiHornem. Aquatic Botany,40 :
343-362.
6-Mostafa, H. M., 1997b. Phosphorus content in seagrass meadows of
Posidonia oceanica(L.) Delile andCymodocea nodosa(Ucria) Ashers off
Alexandria, (Egypt). A proceeding of the 7th International conference on
Environment protection is a must, 20-22 May, Alex, Egypt, (NIOF) and
(ISA) pp. 353-362.
Fig. 1. Components loadings matrix of phenological parameters (leaf
area index, leaf density, shoot density, photosynthetic area and epiphyt-
ic area and Physico-chemical parameters (salinity, temperature, PH,
TOM and dissolved inorganic nutrients).