Rapp. Comm. int. Mer Médit., 36,2001
192
Introduction
Microorganisms in nature generally live and grow in aggregated
forms such as biofilms and ?ocks.Appearence of biofilms in natural
and technological environments causes severe problems.We still do
not understand completely how cells sense the surface no the underly-
ing mechanism of adhesion (1).Employing mercury electrode as in
situ sensor offers detection/identification of single algal cells at fresh-
ly exposed electrode/seawater interfa
c
e .Mercury electrode with
dynamic growth and hydrophobicity can mimic natural ?uid interfaces
while adhesion force can be fine tuned by the changing applied poten-
tial (2).
Experimental
Electrochemical measurements :Dropping mercury electrode was
used because of its well-defined interfacial properties and renewable
surface.The electrochemical experiments were performed in a stan-
dard Methrom vessel 3-electrode system.The mercury electrode was
directly immersed in cell suspension in oxygen-free aqueous 0.1 M
NaCl (pH at 8.2) solution or in seawater.Cell culture :Dunaliella ter-
t
i
o
l
e
c
t
aButcher cells are suitable for electrochemical detection
because of their size, membrane properties, euryhaline nature, and
their ability to form stable suspensions of single cells due to their pro-
nounced motility and low stickness.The cells (maximum dimension
6-12 µm) were grown in seawater enriched with F-2 medium in batch
culture.Cells were separated after 8 days of growth with mild cen-
trifugation and washed several time with filtered seawater.Vialability
of cells was controlled by microscopic observation of cell motility.
Results and discussion
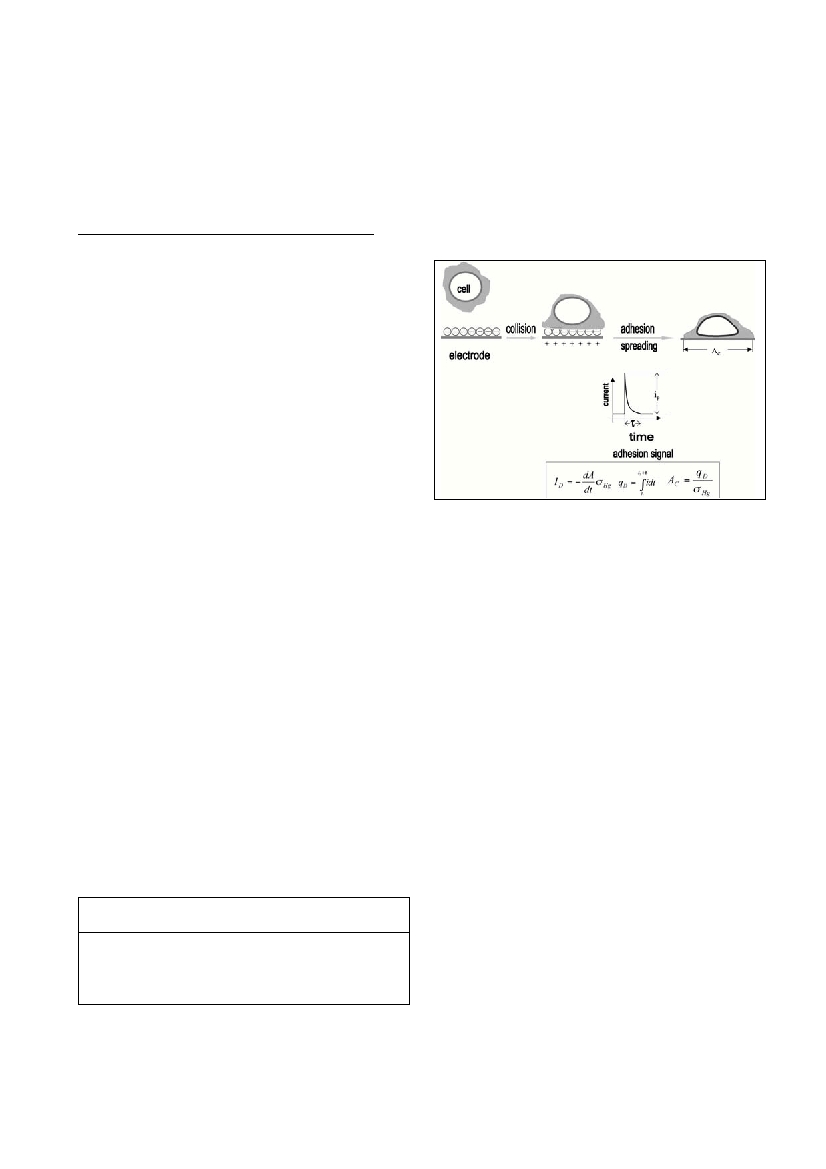
Attractive interaction between a cell and electrode results in a dou-
ble layer charge displacement as represented by a scheme in Figure 1.
The transient ?ow of current re?ects the dynamics of adhesive contact
formation and subsequent spreading of a cell. The signals of individu-
al cells from suspension differ only slightly in the peak current and
duration, indicating attachments from a nearly monodisperse particle
population. The rate of adhesion and spreading of cells is enhanced by
the hydrodynamic regime of electrodeís growing ?uid interface.
Adhesion signals of cells appeared at characteristic potential range,
while outside of this potential range the cells act as inert particles
(even in dense suspension). Potential range for cell adhesion depends
on surface cell properties and their aging. The spike-shaped signals
have the peak current in µA range, duration of 5-10 ms and displaced
charge in nC range. Surprising similarities to adhesion signals of
droplets of liquid hydrocarbons suggest that collective properties of
cell exterior govern the dynamics of adhesion and rate of spreading,
with ?uidity playing a major role. The electrochemical technique thus
allows a precise measurement of the contact area between the cell and
the substrate (Table 1).
TABLE 1. Contact areas (A
C
) of algal cells of different species
and sources (A, B) at the positively and the negatively charged
electrode surface.
The variation in A
C
values can be ascribed to the distribution of cell
sizes in the culture. The contact interface area, A
C
, exceeds cross-sec-
tion area of a free cell by two orders of magnitude. Evidently,D. ter-
tiolectacell ruptured during the spreading process. It is known for
vesicles that strong adhesion always leads to vesicle rupture (2). The
distance of the closest approach of an adhered cell can be estimated
with certainty as equal or smaller than the outer Helmholtz plane i.e.
0.3-0.5 nm.
Conclusion
Our results demonstrate a general significance of adhesion phe-
nomena in single cell-substrate interactions in seawater.The charac-
teristic potential range of adhesion can serve to study the interplay of
complex surface forces involved in soft particle interactions in seawa-
ter and resulting ěstickiness coefficientî. This electrochemical
approach also meets requirements for in situsingle particle analysis
(3).
References
1. Johnson B.D, Kranck K. and Muchenheim D.K., 1994.
Physicochemical factors in particle aggregation. pp. 75-92. In:Wotton
R.S. (ed.), The biology of particles in aquatic system. CRC,
2. Svetlicic V., Ivosevic N., Kovac S., and Zutic V. 2000. Charge
displacement by adhesion and spreading of a cell: Amperometric signals
of living cells. Langmuir, 16: 8217-8220. (references therein)
3. Zutic V., and Svetlicic V., 2000. Interfacial processes. pp. 149-165.In:
Wangersky P. (ed.), The handbook of environmental chemistry, vol.5,
Springer-Verlag.
Rapp. Comm. int. Mer Médit., 36,2001
CELLS AND ELECTRODE, STICKING TOGETHER IN SEAWATER
Nadica Ivosevic*, Vesna Svetlicic, Solveg Kovac,Vera Zutic
Center for Marine and Environmental Research, Ruder Boskovic Institute, Zagreb, Croatia - ivosevic@rudjer.irb.hr
Abstract
Potential controlled electrode surface propertiesoffer a possibility for direct studiesof non-specific interactions between living cells, non-
living particles during aggregation processes or biofilm formation in seawater.Our approach is based on measuring electrical signals of
double-layer charge displacements caused by adhesion of single cells or particles.Unicellular marine alga, dunaliella tertiolecta of
micrometer size and ?exible cell enveloppe was used as a model particle.The dropping mercury electrode acted in situ adhesion sensor
and the electrochemical technique of chronoamperometry allowed precise measurement of the spread cell-electrode interface area and
the distance of the closest approach of a cell.
Keywords : algal cells, electrochemistry, fouling, interface.
ALGALCELLSLENGTHCONTACTINTERFACE/ x 10
-4
cm
2
/µm
s
Hg
= +3.8 µC/cm
2
s
Hg
= -6.5 µC/cm
2
D.tertiolecta (A)
6-122.88 ± 0.53
1.73 ± 0.23
D.tertiolecta (B)
6-91.25 ± 0.23
0.68 ± 0.15
I.galbana
3.7-7.51.02 ± 0.6
0
0.57 ± 0.3
0
Figure 1.Attractive between cell and positively charged mer-
cury electrode in seawater.The adhesion signal is caused by
the double-layer charge displacement from the contact area
A
C
.