Rapp. Comm. int. Mer Médit., 36,2001
198
In recent years, FCM, by virtue of a growing diversity of measur-
able parameters, has become an important tool in areas of cell biology
related to cell proliferation, differentiation and response of cell dam-
age. Use of FCM in identifying the cytological results of exposure to
environmental pollutants is still in infancy. Nevertheless, early work
has shown that FCM is a powerful tool for identifying and measuring
effects of environmental contaminants on the vertebrate genome (1, 2).
As far as mussels are concerned, FCM was performed in determina-
tion of abnormalities in DNA content distribution and progression in
neoplastic disorders (polyploid forms) of mussels from heavily pollut-
ed area such as Puget Sound, Washington, USA (3). Therefore, our
study has focussed in determination of cell cycling alternations in
mussel haemocytes caused by environmental contamination in “mus-
sel watch” experiment as well as from haemocytes and gills of mus-
sels collected from different locations of different polluted areas along
the Adriatic coast.
For the mussel watch experiment, mussels (average weight 10 g)
were transferred from mariculture area to the selected site and were
held in a net anchored at the low neap tide level. After different time
intervals, 6 hours and 1,2,3,6,14 and 28 days, mussels were collected
and their DNA content in haemocytes was analyzed by FCM. For
biomonitoring purposes mussels (average weight 6 g) were collected
at different locations so called “hot spots” along the Adriatic coast.
Haemolymph was withdrawn from the posterior adductor muscle of
i
n
d
ividuals, dispersed in DAPI/DMSO (4,6-diaminido-2-pheny
l
indol/dimethylsulphooxide) solution. A piece of gills were removed
from mussels (average 2 mg) and stored as well as haemolymph
DAPI/DMSO solution under the liquid nitrogen until FCM analysis
was performed. Stained samples were analyzed on PAS II ?ow
cytometer (Partec, Münster, Germany) under the following conditions:
excitation - 100 W mercury lamp, UG 1 (290-490 nm, 3mm), chro-
matic beam splitter (TK 420), emission beam splitter (TK420,
TK560), barrier filter (GG 455) for DAPI signals. The data are shown
as one parameter frequency histograms or as a percentage of DNA in
different cell cycle stages.
Time dependent effect of industrial waste on DNA content distribu-
tion in mussel haemocytes are shown in Table 1. During two days of
exposure, mussels under direct in?uence of industrial and urban runoff
near a fish cannery showed the increased number of haemocytes in
G
2
/M cell cycle state (2.9 ± 2.0 up to 13.3 ± 2.9%), while the percent-
age of DNA in S-phase remained unchanged (3.6±1.3 to 3.3 ± 1.9 %).
Further differences between starting conditions of mussels transferred
from uncontaminated area and conditions after 6 days of exposure of
mussels to contaminated area, could not be detected. The variations in
G
0
/
G
1
and G
2
/
G
M
phases could be attributed to the G
1
-arrest and G
2
-
delay in haemocytes DNA that provide more time for repair of damaged
D
NA as it was detected after 6 days of exposure. Besides mussels wa
t
c
h
experiments we applied the FCM for determination of cell cycle alter-
ation in mussels collected from differently polluted sites along the
Adriatic coast. Preliminary results showed the presence of contaminants
at one sampling site that altered the cell cycle in mussel haemolymph
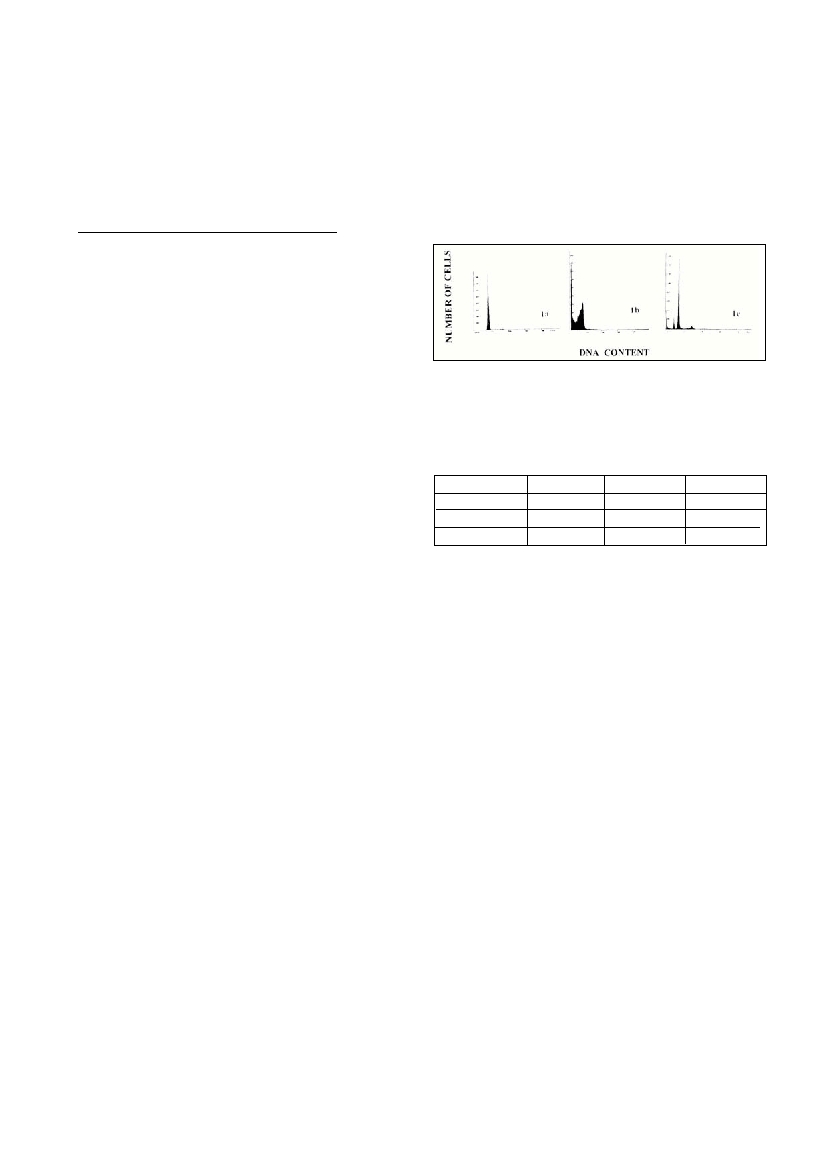
the (Fig.1c) as well in mussel gills (Fig.1b). Cell cycle alteration of gills
D
NA content of mussel collected from location 1 showed a reduction of
G
0
/
G
1
phase concomitant with selective loss of G
2
/M phase which
could be attributed to the apoptotic process (confirmed by electroforetic
“
l
a
d
d
e
r-
l
i
ke” DNA pattern, data not shown). The type of alteration in
mussels which occurred in mussel collected at location 2 could be due
to the occurrence of subpopulations of haemocytes whose whole chro-
mosomes may be lost or gained. This phenomenon has to be elucidated
with further inve
s
t
i
gations (e.
g.chromosome analysis).
References
1. Jenner NK. Ostrander GK. Kavanagh TJ. Livesey JC. Shen MW. Kim
SC. Holmes EH. A ?ow cytometric comparison of DNA content and
glutathione levels in hepatocytes of English sole (Parophyrs vetulus)
from areas of differing water quality.Arch. Environ. Contam. Toxicol.,
19(6):807-15.
2. Lowcock L.A., Sharbel T.F., Bonin J., Ouellet M., Rodrigue J.,
Desgranges J.L., 1997. Flow cytometric assay for in vivo genotoxic
effects of pesticides in Green frogs (Rana clamitans).Aquat.Toxicol.,
38(4): 241-255.
3. Elston R.A., Drum A.S., Allen S.K.Jr., 1990. Progressive development
of circulating polyploid cells in Mytiluswith haemic neoplasia. Dis.
Aquat. Org., 8: 51-59
CELL CYCLYING ALTERATIONS IN THE BLUE MUSSELMYTILUS GALLOPROVINCIALIS
CAUSED BY ENVIRONMENTAL CONTAMINATION
Milena Micic *, Nevenka Bihari
Center for Marine Research Rovinj, Rudjer Boskovic Institute, Rovinj, Croatia - micic@cim.irb.hr
Abstract
Flow cytometry (FCM) was employed to determine cell cycling alteration caused by environmental contamination in mussel Mytilus
galloprovincialishaemocytes and gills. The G
1
-arrest and G
2
-delay have been detected in haemocytes of mussel in “mussel watch”
experiment, when mussels have been transferred from mariculture area to the location under direct in?uence of industrial and urban runoff
near a fish cannery.The cell cycling alterations in haemocytes and gills mussels collected from some polluted sites along the Adriatic coast
were observed as well.
Keywords : Ecotoxicology, Bivalves, Pollution, Cell
Figure 1. Comparison of DNAhistograms of haemocytes or
gills of mussels collected from reference site and so called “hot
spots” along the Adriatic coast.
1a. Haemocytes of control mussel.
1b. Gills of mussel collected at location 1 along the Adriatic coast.
1c. Haemocytes of mussel collected at location 2 along the Adriatic
Time of exposureG
0
/G
1
S
G
2
/M
0
93.5 ± 1.73.6 ± 1.7
0
2.9 ± 2.0
2 days82.6 ± 3.63.3 ± 1.913.3 ± 2.9
6-28 days92.3 ± 0.63.9 ± 0.5
0
3.8 ± 0.7
Table 1. Cell cycle variation in haemocytes of mussel Mytilus
galloprovincialisexposed to waste waters of fish cannery.