Rapp. Comm. int. Mer Médit., 36,2001
383
Already in 1913, an environmental publication of the Smithsonian
Institution noted that “life is the reaction of the living substance to the
ceaseless play of the environment”. Man-made environmental factors are
especially prominent in the near-shore habitats of enclosed seas, exe
m
p
l
i-
fied by the Mediterranean Sea, the Gulf of Aqaba and similar basins. T
h
e
s
e
n
ega
t
ive in?uences have become especially disturbing during the last 50
years, as thousands of biologically active substances find their way into the
littoral, causing a decline in species richness and inducing pathological
alterations in the surviving taxa (1,2). Consequently, assemblages of geno-
types were confronted with new selection regimes. As a result, new fit
t
i
n
g
mechanisms have become activated, showing features of successive selec-
tion, especially changes in polymorphism (3). Today this constitutes the
very essence of response to environmental stress, in which genotypes of
s
p
e
c
i
fic phenotypic qualities either vanish or must recombine their biologi-
cal qualities to form novel genotypes suited to the demands of the habitat.
One of the first such described adaptive forms was the “industrial race” of
bu
t
t
e
r
?ies, whose melanistic pattern blended into the darkened tree-trunks.
N
evo and Laevi (3, 4) described such developments in some Mediterranean
molluscs. During the last five years we have studied a group of littoral mol-
luscs from both clean and polluted sites, recognized by us as good indica-
tors of environmental health (5, 6). These included two species of patellid
gastropods, Patella caerulea(Mediterranean Sea) and Cellana ro
t
a(
R
e
d
Sea), and three species of biva
l
ves, Pteria aeg
y
p
t
i
a(Red Sea), B
ra
ch
i
d
o
n
t
e
s
p
h
a
ra
o
n
i
sand Donax trunculus(Mediterranean Sea). Using in vitro and in
v
ivo ?uorescent and ?uorimetric methods as described by Bresler et al.(
5
)
,
we compared in these taxa the state of defense systems, such as multixe
n
o-
biotic resistance transporters (MXRtr) and the system of active transport of
o
rganic anions (SATOA), the permeability (PERM) of the external epithe-
lia, the levels of micronucleation (MNT), and other parameters. The results
s
h
owed that the populations from polluted sites differed signific
a
n
t
l
y
(p<0.05, t-test for comparisons of means) from those from the clean sites
(
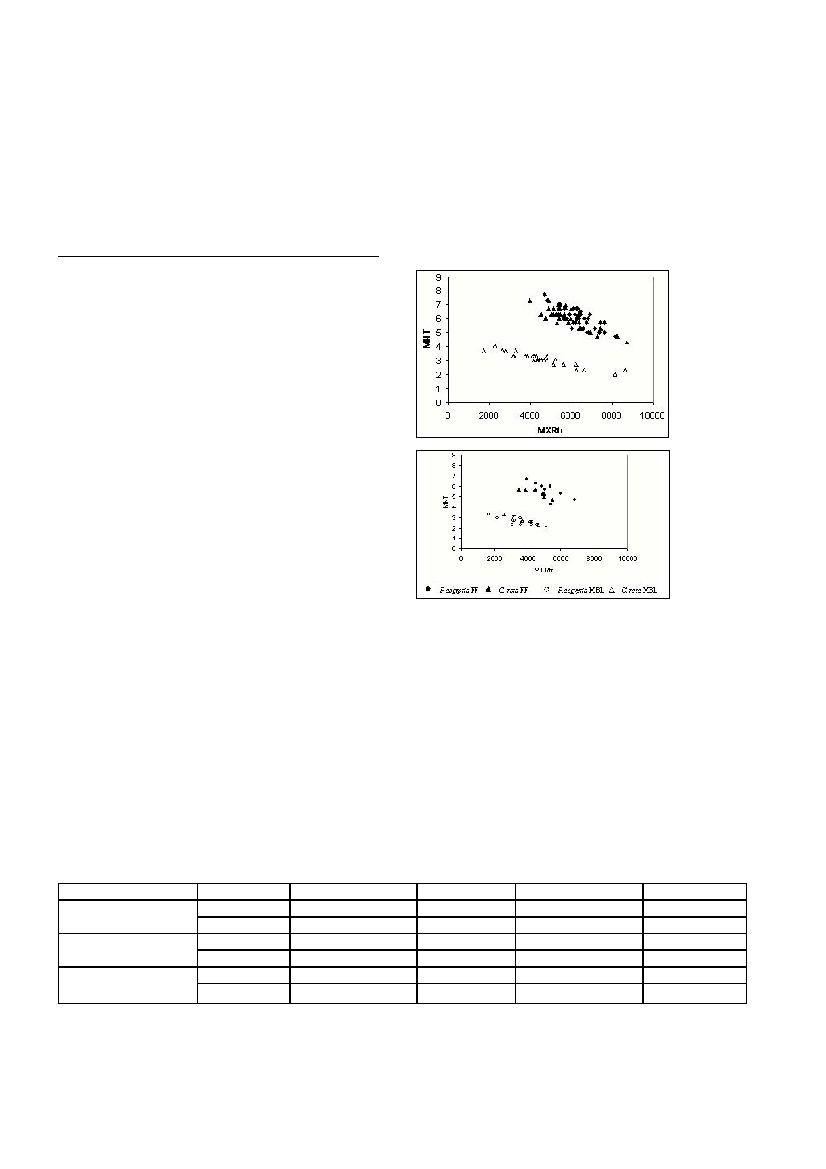
Table 1); correlation procedures also corroborated these results. Figure 1
compares samples of Donax trunculusfrom sandy shores of the Israeli
Mediterranean. A conve
rgent picture is shown by the Red Sea patellid
Cellana ro
t
aand the Mediterranean Patella caerulea(Fig. 2). In both
basins, the populations of the two taxa from polluted and clean sites are def-
initely separated. Moreove
r, in each site samples of the two taxa are closer
to each other than to their con-specifics in other sites. It would be safe to
assume that the examined features are, at least partly, genetically controlled,
r
e
?ecting changes in genotype frequencies, probably due to action of limit-
ed, local selection. The results of such selective processes will depend pri-
marily on three major factors: the strength and duration of the stressors, and
the ability of the populations to adapt. An additional and important fa
c
t
o
r
for stabilization of the novel phenotypes depends on the transport of their
propagules. The shorter living these stages will be, the more rapidly the
locally produced genotypes become fixe
d
.
Figure 1. MNT
and MXRtr
values (in
arbitrary units)
of ninety
specimens of
D. trunculus
from three
sites in the
Mediterranean
(black marks =
polluted).
Figure 2. MNT
and MXRtr
values (in
arbitrary
units) of P.
aegyptiaand
of C. rotafrom
the Red-Sea
(black marks =
polluted). MBL
= Marine
Biological
Laboratory
(reference site); FF= fish farming cages (polluted site).
References:
1.Fishelson L., 1995. Eilat (Gulf of Aqaba) littoral: life on the red line of
biodegradation. Israel J. Zool., 41, 43-45.
2. Bresler V. and YankoV., 1995. Chemical ecology: a new approach to the
study of living benthic epiphytic foraminifera.J. Foram. Res., 28, 267-279.
3. Nevo E. and Laevi B., 1989. Selection of allozyme genotypes of two
species of marine gastropods (genusLittorina) in experiments of
environmental stress by nonanionic detergent and crude oil-surfactant mixture.
Genet. Select. Evol., 21, 295-302.
4. Nevo E. and Laevi B., 1989b. Differential viability of allelic isozymes in
marine gastropods Cerithium scabridumexposed to the environmental stress
of nonanionic detergent and crude oil-surfactant mixture. Genetica, 78, 205-
213.
5. Bresler V., Bessinger V., Abelson A., Dizer H., Sturm A., Kratke R.,
Fishelson L. and Hansen P. -D., 1999. Marine mollusks and fish as biomarkers
of pollution stress in littoral regions of the Red Sea, Mediterranean Sea and
North Sea. Helgolander Mar. Res., 53, 219-243.
6. Sultan A., Abelson A., Bresler V., Fishelson L. and Mokady O., 2000.
Biomonitoring marine environmental quality at the level of gene-expression-
INDUCTION OF NOVEL RE-SEGREGATION AND SELECTION PROCESSES BY
ANTHROPOGENIC FACTORS ON LITTORAL MARINE MOLLUSCS
Fishelson L.
1
*, Bresler V.
2
, Rosenfeld M.
1
, Mokady O.
2
,Abelson A.
2
, Stone L.
1
1
The Department of Zoology and
2
The Institute of Nature Conservation Research,
The George S. Weise Faculty of Life Sciences, Tel Aviv University, Israel - fishelv@ccsg.tau.ac.il
Abstract
Various in vivo and in vitro methods, contact microscopy and ?uorescent markers, were used by us to compare several populations of
molluscs from polluted and reference sites along the Israeli littoral in the Mediterranean Sea and the Gulf of Aqaba (Red Sea). The
parameters compared included multixenobiotic and antianionic defense systems, micronucleation, membrane permeability and
cholinesterase activity. In all species studied the samples from the polluted sites differed markedly from these of the reference sites in all
the investigated parameters. Based on the data we hypothesize the occurrence of a special type of stress-induced selection in which specific
genotypes proved more fit under stress.
Key words: Anthropogenic stressors, marine molluscs, selection
Species
SITE
MXRtr
MNT
SATOA
PERM
Brachidontes pharaoni
Reference4112.20 ± 988.132.43 ± 0.33
265.20 ± 34.11
4.34 ± 0.28
Polluted
7433.40 ± 790.755.50 ± 0.60
379.20 ± 42.15
7.96 ± 0.56
Donax trunculus
Reference4398.70 ± 659.223.12 ± 0.43
303.15 ± 47.58
3.55 ± 0.25
Polluted
6328.45 ± 1735.176.32 ± 0.76
344.00 ± 36.09
6.00 ± 0.21
Patella caerulea
Reference5046.90 ± 995.452.66 ± 0.31
294.00 ± 57.45
4.05 ± 0.21
Polluted
7631.00 ± 522.995.81 ± 0.66
397.80 ± 17.92
7.40 ± 0.75
Table 1. Average ± standard deviation values of defense systems activity in some of the studied molluscs sampled from polluted and reference sites